半导体材料的发展经历了三个阶段:第一阶段以硅基材料为代表,第二阶段以砷化镓材料为代表,第三阶段以氮化镓材料为代表。在砷化镓晶片生产过程中,晶片表面清洗、湿法刻蚀、减薄及划片等环节会产生含砷(As)废水,废水中主要污染物为酸碱和总砷。目前处理高浓度含砷废水的方法主要是化学沉淀法,包括硫化物沉淀法、中和沉淀法和铁盐沉淀法等。硫化物沉淀法是通过投加硫化钠(Na2S),与废水中的亚砷酸根(AsO33-)和砷酸根(AsO43-)反应,形成硫化砷(As2S5)和硫化亚砷(As2S3)沉淀。中和沉淀法主要是通过投加钙盐,提升废水pH值,并使废水中AsO33-和AsO43-与钙盐形成难溶于水的亚砷酸钙和砷酸钙沉淀。铁盐沉淀法主要是通过投加铁盐,形成不溶性的亚砷酸铁(FeAsO3)和砷酸铁(FeAsO4)化合物,同时利用投加铁盐后产生的水合铁氧化物的絮凝性能,进一步吸附游离的砷化物,形成共沉淀。因此,与硫化物沉淀法和中和沉淀法相比,铁盐沉淀法的除砷效率较高。由于AsO33-所带的负电荷较AsO43-少,因此AsO33-较AsO43-更难于被水合铁氧化物吸附。此外,由于As(Ⅲ)的毒性远高于As(V),因此在采用铁盐沉淀法时宜先将废水中的As(Ⅲ)氧化为As(V),然后再加入铁盐。
将As(Ⅲ)氧化成As(V),常用的氧化方法包括空气氧化和化学药剂氧化。空气氧化是通过向废水中鼓入空气,利用空气中的氧气将As(Ⅲ)氧化成As(V)。化学药剂氧化是废水中加入化学氧化剂来进行As(Ⅲ)的氧化,目前常用的化学氧化剂有次氯酸钠(NaClO)、过氧化氢(H2O2)以及臭氧(O3)等。赖兰萍等分别采用NaClO、H2O2和空气来氧化处理钨冶炼含砷废水,比较了氧化剂用量、反应时间以及达到同样去除效率时氧化剂的费用,结果显示H2O2要明显优于NaClO和空气。因此,本文采用预氧化-铁盐沉淀法,以H2O2为氧化剂,氯化铁(FeCl3)为铁源,处理砷化镓晶片生产过程中产生的高浓度含砷废水,首先确定了氧化剂H2O2的投加量,然后考察了n(Fe)与n(As)比值、pH值和反应时间等试验条件对砷去除效果的影响,以期为高浓度含砷废水的处理提供参考。
1、材料与方法
1.1 试验材料
试验过程中采用的化学药剂均为分析纯,购自国药集团。试验废水取自扬州某砷化镓半导体生产企业的生产废水,废水产生量为40m3/d,废水为半透明白色浊液,有刺激性气味,pH值为12.07,总砷含量为884mg/L。
1.2 水质分析方法
pH值采用PHS-3C精密pH计进行测定,总砷含量采用原子荧光法进行测定。
1.3 试验方法
取一定量的试验废水,向废水中加入一定量的30%H2O2溶液;反应30min后,用10%H2SO4溶液调节废水pH值至2.0;加热蒸干,冷却至常温后加纯水定容至100mL;然后再利用碳酸氢钠(NaHCO3)溶液调节pH值至8.0;滴加I2-KI溶液,如此时溶液由棕色变为无色,则证明废水中的As(Ⅲ)被氧化剂完全氧化成As(V)。利用此方法来确定氧化剂H2O2的投加量,预试验结果表明,30%H2O2最佳的投加量为1.5mL/L。
取一定量的试验废水,向废水中加入1.5mL/L30%H2O2溶液进行预氧化,在设定试验条件(n(Fe)/n(As)、pH值、反应时间)下向废水中加入FeCl3溶液和氢氧化钠(NaOH)溶液。待反应完成后,过滤分离,采用原子荧光法测定滤液中砷的质量浓度。
2、结果与讨论
2.1 n(Fe)/n(As)对砷去除效果的影响
控制废水pH值为8.0,控制反应时间为120min,调节n(Fe)/n(As)值分别为1∶1、1.5∶1、2∶1、2.5∶1、3∶1、3.5∶1、4∶1。n(Fe)/n(As)对砷去除效果的影响如图1所示。
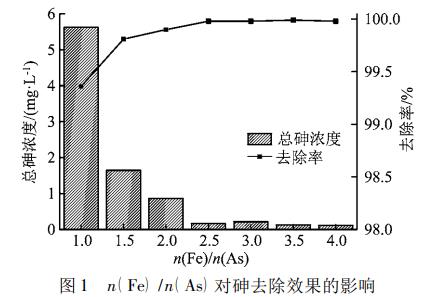
由图1看出,当n(Fe)/n(As)从1∶1提升到2.5∶1时,出水总砷浓度从5.624mg/L快速降低至0.164mg/L;当n(Fe)/n(As)从2.5∶1进一步提升到4∶1时,出水总砷浓度从0.164mg/L缓慢降低至0.114mg/L。结果表明,在一定pH值和反应时间条件下,铁盐投加量应超过理论投加量,才能取得较好的除砷效果,且铁盐的投加量越大,砷的去除效果越好。在本试验中,n(Fe)/n(As)为2.5∶1时,出水总砷浓度为0.164mg/L,已满足项目环评要求的0.2mg/L的排放限值要求,且铁盐投加量较为适中,经济性较好。因此,n(Fe)/n(As)确定为2.5∶1。
2.2 pH值对砷去除效果的影响
调节废水pH值分别为6.0、7.0、8.0、9.0、10.0、11.0、12.0,控制n(Fe)/n(As)为2.5∶1,控制反应时间为120min。pH值对砷去除效果的影响如图2所示。
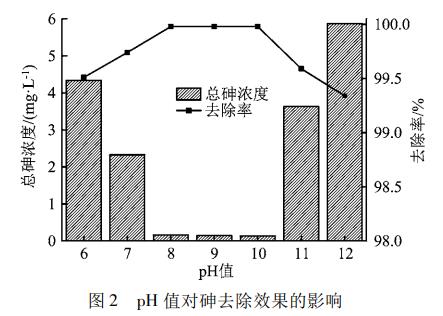
由图2看出,当废水pH值从6.0提升到8.0时,出水总砷浓度从4.338mg/L快速降低至0.164mg/L,再从8.0提升到10.0时,出水总砷浓度降低得十分缓慢。但是,pH值从10.0进一步提升到12.0时,出水总砷浓度从0.136mg/L又快速回升至5.872mg/L。结果表明,弱碱性环境有利于铁盐共沉淀除砷。强碱性环境下,铁离子主要以铁的羟基配合物形式存在,从而导致反应产生的FeAsO4沉淀物出现反溶现象,并导致出水中总砷浓度急剧升高。在本试验中,废水pH值为8.0时,出水总砷浓度为0.164mg/L,满足项目环评要求的0.2mg/L的排放限值;且相对于pH值9.0和10.0,pH值为中性时所需碱的用量更少,更为经济。因此,废水的反应pH值确定为8.0。
2.3反应时间对砷去除效果的影响
控制废水pH值为8.0,控制n(Fe)/n(As)为2.5∶1,调节反应时间分别为0.5、1.0、1.5、2.0、2.5、3.0h。反应时间对砷去除效果的影响如图3所示。
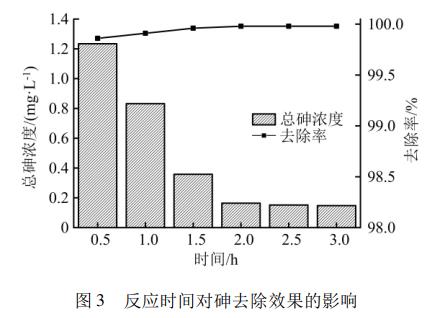
由图3可知,当反应时间从0.5h提升到2.0h时,出水总砷浓度从1.234mg/L快速降低至0.164mg/L。当反应时间从2.0h进一步提升至3.0h时,出水总砷浓度从0.164mg/L缓慢降低至0.148mg/L。结果表明,延长反应时间有利于铁盐与AsO43-充分反应,提升除砷效果。在本试验中,废水时间为2.0h时,出水总砷浓度为0.164mg/L,满足项目环评要求的0.2mg/L的排放限值要求,且相较于反应时间2.5h和3.0h对反应池有效容积要求更小,更为经济。因此,废水反应时间确定为2.0h。
3、结论
采用预氧化-铁盐沉淀法对砷化镓半导体生产过程中产生的高浓度含砷废水进行处理,研究确定了氧化剂H2O2的用量,考察了n(Fe)/n(As)、pH值和反应时间等试验条件对砷去除效果的影响。得到如下结论:①H2O2能够有效氧化高浓度半导体生产含砷废水中的As(Ⅲ),30%H2O2用量为1.5mL/L,即可将废水中的As(Ⅲ)完全氧化As(V)。②在n(Fe)/n(As)为2.5∶1,pH值为8.0,反应时间为2h时,铁盐沉淀法可有效去除高浓度半导体生产含砷废水中的砷,出水总砷浓度为0.164mg/L,满足项目环评要求的0.2mg/L的排放限值。(来源:无锡安维特环保科技有限公司,常州大学环境与安全工程学院,苏州市环境卫生管理处)
