随着经济快速发展和人口增加,厨余垃圾数量日趋增多。在生活垃圾组成中,厨余垃圾占了四到六成。由于数量多,有机物质含量高,厨余垃圾给环境带来了巨大的污染,引起了中国政府的关注。厨余垃圾含水量高,有机物含量高,是理想的厌氧消化基质。因此,国内一些已建和在建的厨余垃圾处理项目,大多选择以厌氧消化为主的工艺,即经过筛选与除油之后进行厌氧消化处理。厌氧消化过程中产生的残渣用于生产有机肥,产生的生物燃气被回收利用。因此,厌氧消化是厨余垃圾资源化的主要途径。厌氧消化包括4个过程:水解、酸化、产乙酸和产甲烷。在厨余垃圾水解酸化过程中会产生大量挥发性脂肪酸(VFAs),主要是乙酸、丙酸、丁酸和戊酸等。研究发现,厨余垃圾发酵液的VFAs产量(VFA/COD)高达221g/kg。并且,厨余垃圾发酵液中产生的乙酸含量最多,大约为总挥发酸含量的70%,其次是丁酸(20%)和丙酸(10%)。另外,水解酸化过程中还会将含氮物质降解为蛋白质,进一步水解为氨。因此,厨余垃圾厌氧发酵后的沼液是含高氨氮和高挥发酸的废水,一般需经生化二级处理达标后才能进行排放。
目前,基于生物方法的硝化和反硝化技术被广泛应用于废水脱氮。反硝化脱氮的核心是电子传递和消耗有机物的过程,是硝酸盐与碳物质的氧化还原反应,以硝酸盐为电子受体,有机物为电子供体。所以,在反硝化脱氮过程中需要足量的碳源,才能有效脱出总氮。在低C/N废水中,往往要额外添加碳源,才能保证稳定的脱氮效率。研究表明,厨余垃圾厌氧发酵液中的VFAs是一种优良的低成本碳源。Ji和Chen发现,在短程硝化反硝化过程中,添加发酵液的总脱氮效率为98.7%,高于添加乙酸的去除率(79.2%)。Kim等将厌氧发酵液中的VFAs、乙醇和一种商业用有机碳作为碳源进行反硝化测试,结果表明发酵液作为反硝化碳源的反应速率和滞后长度都是最有效的。
反硝化脱氮是由微生物主导的过程,研究表明添加发酵液为碳源的污泥样品中Proteobacteria、Chloroflexi、Bacteroidetes和Acidobacteria是主要的微生物门,Zoogloea和Thauera等是主要的功能微生物。目前,关于发酵液作为反硝化碳源的研究仅从微生物群落组成方面进行解析,而对其中涉及的功能基因变化及碳氮代谢等均还未深入研究。因此,我们采用序批式反应器(SBR)反硝化工艺进行长期的脱氮试验,逐渐提高进水硝酸盐的浓度,添加混合挥发酸来模拟发酵液作为反硝化碳源,研究该系统的脱氮性能,以及反硝化功能微生物结构和功能基因的变化,并通过宏基因组测序来揭示微生物的碳氮代谢过程。实际的脱氮表现和微生物分析结合起来将更全面地评价混合挥发酸是否是一种优良的反硝化脱氮碳源;另外,微生物层面的研究也会为提高反硝化效率提供一些启示。
1、材料与方法
1.1 SBR试验装置与运行
进行长期脱氮试验的装置如图1,反应器的主体为厌氧血清瓶,总容积为2L,有效容积为1.2L。该反应器设有5根管道,用于进水(碳源和硝酸盐废水分开进样)、出水,排气和微生物取样。反应器采用3个蠕动泵控制进出水。采用小型磁力搅拌器(JOANLAB-MS5)来混匀液体和污泥。蠕动泵和磁力搅拌器的运行和关闭均由定时器控制。整个反应装置放置培养箱中并保持温度30℃运行。
反应器执行4h循环程序,反应器的运行周期包括10min出水(流速为40mL/min),14min的进水(10min的合成的硝酸盐废水进水,流速为40mL/min;4min的碳源进水,流速为10mL/min),同时进行40min搅拌(转速为1800r/min),190min的静置。每个周期进水共400mL,出水400mL,维持有效体积为1.2L,水力停留时间为12h。初始反应器均接种800mL的挥发性悬浮固体浓度(MLVSS)为2400mg/L的混合污泥,反应器正式运行后,保持污泥龄(SRT)为25d,MLVSS控制在4500-5500mg/L。

1.2 污泥的接种与试验阶段废水的组成
接种和驯化的污泥取自双流嘉博文餐厨垃圾处理厂(成都)沼液生化处理A/O系统。取回到实验室后放于4℃冰箱保存,并且尽快混合接种到预培养桶中,加入培养基,调节pH至7左右。定期补充营养物质,驯化培养10d。
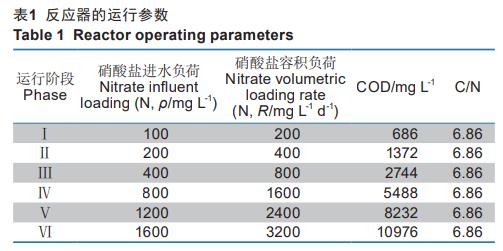
根据进水硝酸盐的浓度,反应器正式运行共分为6个阶段,具体见表1.反应器进水的合成硝酸盐废水组分(1L)具体如下:50mgNa2HPO4,150mgKH2PO4,70mgCaCl2,400mgMgSO4,100mgNH4Cl,1mL微量元素I和0.1mL微量元素II。氮源由硝酸钠提供,阶段Ⅰ至阶段Ⅵ添加的氮源分别为0.607、1.214、2.428、4.857、7.285、9.714g/L。由于反硝化会产生碱度,因此培养基最终pH调节至6.5左右。碳源的添加按照C/N=6.86,由乙酸钠、丙酸钠和丁酸钠按照7:1:2的质量比例混合提供。
1.3 批次试验方案
反应器运行至阶段Ⅵ末期,取污泥进行硝酸盐反硝化潜势的测定。首先配制不含有硝酸盐和有机碳源的培养基。取500mL培养基加入1214.285mg硝酸钠,并按照C/N为6.86加入1758.975mg乙酸钠、1372mg丙酸钠和1182.758mg丁酸钠的混合物。混合均匀后往3个厌氧瓶中各加入100mL碳源、硝酸盐和培养基的混合液,并作好标记。同时,从反应器中取污泥混合液40mL,离心取沉淀。用培养基(未添加硝酸盐和有机碳源)清洗3次后,加入40mL培养基,混合均匀,用于接种。将污泥混合液接种至上述3个厌氧瓶中,每瓶接种5mL。混合均匀,各瓶取1mL液体,用于测定初始硝酸盐浓度。最后,3个厌氧瓶各曝N25min,盖上塞子,置于摇床30℃培养,每1h取液体样品一次,共取5次,测硝酸盐浓度。
1.4 试验分析与测定方法
长期实验过程中,每天连续监测出水的NO3--N和NO2--N浓度。出水NO3--N和NO2--N浓度通过紫外分光光度计进行检测。脱氮效率(NRE)通过以下公式来计算:
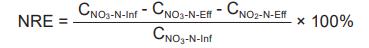
式中,CNO3-N-Inf为进水硝酸盐的浓度(mg/L),CNO3-N-Eff为出水硝酸盐的浓度(mg/L),CNO2-N-Eff为出水亚硝酸盐的浓度(mg/L)。
出水中VFAs的测定使用配备FID柱火焰电离检测器(FID)和毛细管柱(DB-FFAP,USA,30m×0.25mm×0.25mm)的气相色谱仪(Agilent6890N)。标准曲线的制定:使用一系列梯度的已知浓度的乙酸、丙酸、正丁酸、异丁酸、异戊酸、正戊酸的混合样品,测定其峰面积,建立浓度和峰面积的线性关系。测定前,样品需要经过预处理,首先取2mL样品离心(1000r/min,10min),取上清液1mL于新的离心管中,加入100μL甲酸,离心(1000r/min,10min),用注射器取上清液过0.45μm滤膜至新的离心管中待测,每次的进样量为1μL。
1.5 污泥样品的微生物分析
1.5.1 微生物样品的取样和DNA提取
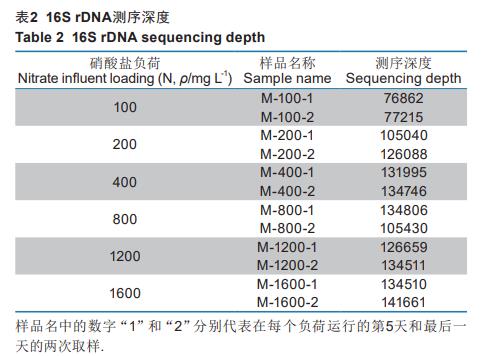
分别在每个阶段开始运行后的第五天和最后一天取微生物样品,共12个样品,放置-40℃冰箱保存。
称取湿重为0.25g左右的污泥,使用土壤DNA提取试剂盒(TIANGEN,China)进行DNA的提取。DNA浓度和纯度的鉴定采用NanoDrop(NANODROP2000,ThermoScientific,USA)。然后将提取的DNA部分稀释至10ng/μL,用于后续的PCR扩增和实时荧光定量PCR(qPCR)。
1.5.2 PCR扩增、测序和下机数据处理
使用515F(GTGYCAGCMGCCGCGGTAA)和909R(CCCCGYCAATTCMTTTRAGT)引物来扩增16SrRNA基因的V4-V5的高变区。扩增条件为:94℃预热3min,然后94℃变性40s,56℃退火60s,72℃加热60s,共30个循环,最终72℃下延伸10min。扩增后的PCR产物使用浓度为1%的琼脂糖凝胶电泳检测,扩增的长度约为500bp,然后对目的条带用胶回收试剂盒DNAGelExtractionKit(擎科生物公司)回收产物。文库构建使用TruSeq®DNAPCR-FreeSamplePreparationKit建库试剂盒,Qubit和qPCR定量构建好文库,文库合格后,采用Illumina测序平台进行上机测序。扩增子测序得到的下机数据,需要进行拼接、质量过滤、OTU聚类、嵌合体去除和重抽样等步骤,每个样品测序深度如表2,并以41427条序列进行重抽样(resampling)。最后对生成的扩增序列变体(Ampliconsequencevariants,ASV)进行丰度、α和β多样性指数等分析以及后续分析。原始测序数据已上传NCBI,登录号为PRJNA936989。
1.5.3 荧光定量PCR(qPCR)
使用实时荧光定量PCR(qPCR)来定量各个阶段样品的nosZ基因的拷贝数。功能基因扩增使用的引物是nosZ-F和nosZ-R。反应的总体系为10μL,包括5μL2×TSINGKE®MasterqPCRMix(SYBRGreenI),上游和下游引物各0.5μL,1.5μLDNA模板(10ng/μL)和2.5μL的ddH2O。每个样品设置3个重复,使用CFX384实时荧光定量PCR仪(Bio-Rad,USA)进行扩增。将所有DNA样品等体积混合后扩增,取其产物作为模板DNA(稀释到10ng/μL),然后进行梯度稀释(10-1、10-2、10-3、10-4、10-5、10-6、10-7)作为标准样品。扩增效率在90%以上,标准曲线的R2大于0.99,且阴性对照不出现荧光信号。最后,根据已知浓度的标准样品的DNA浓度(换算为拷贝数)与Ct值的关系算出样品的基因拷贝数(copies/MLSS,g-1)。
1.5.4 宏基因组测序
用于宏基因组测序的DNA与微生物群落分析的相同。首先,评估DNA质量,包括DNA浓度、降解和污染情况。基因组DNA样品通过超声处理片段化至350bp的大小。NEBNext®ULtra™DNALibraryPrepKit(NEB,美国)用于生成测序文库。在Illumina平台(Illumina,USA)上对DNA文库进行测序,并生成150bp的配对端读数。使用fastp(版本0.20.0)筛选原始数据以获取cleandata。然后将优化的序列用于剪接组装(Megahi,1.1.2版)和基因预测(MeteGene)。所有样本的预测基因序列均采用CD-HIT(版本4.6.1)进行聚类,并构建非冗余基因集。Blastp(版本2.3.0)被用作将非冗余基因序列与NCBINR数据库(e≤10-5)进行比对和分类注释。根据京都基因和基因组百科全书(KEGG,版本2.3.0版)数据库对基因进行注释。
1.6 数据统计与分析
所有微生物的分析与作图均采用Rversion4.2.0.使用“ggplot2”包进行作图。使用“vegan”包完成基于BrayCurtis距离的主坐标分析(principlecoordinateanalysis,PCoA)和影响微生物群落的环境因子的冗余分析(RDA),以表示微生物群落结构的差异。用Manteltest来分析功能基因nosZ的拷贝数与功能微生物的关系。其他图片均使用Origin2018绘制。
2、结果与讨论
2.1 反应器长期运行和批次实验结果
反应器一共运行了92d,长期运行过程中进水硝酸盐浓度、出水硝酸盐浓度、出水亚硝酸盐浓度、进水硝酸盐容积负荷以及脱氮效率的变化情况如图2a。在阶段Ⅰ,进水硝酸盐浓度(以N计,下同)为100mg/L时,出水硝酸盐浓度很低,亚硝酸盐浓度为零,脱氮效率高达99%。进水硝酸盐为200mg/L时,系统出现了一些波动,出水硝酸盐浓度最高达7.66mg/L,出水亚硝酸盐积累浓度达47.82mg/L,脱氮效率为72%。在阶段Ⅲ-阶段Ⅳ,系统表现趋于稳定,脱氮效率基本维持在95%以上。阶段Ⅴ后期和阶段Ⅵ的前几天,系统再次出现了波动,脱氮效率降低到80%,但是在经过短暂几天的波动后,系统脱氮效率恢复到99%以上。王弄潮等的研究表明总氮负荷波动会影响厌氧氨氧化与反硝化协同的脱氮系统的稳定性,总氮负荷波动达到2.10kgm-3d-1时氮的去除会降低50%,而在我们的研究中,在负荷为3200mgL-1d-1时系统只出现了短暂几天的波动后出水指标合格,这表明使用混合挥发酸的反硝化系统具有较强的稳定性。
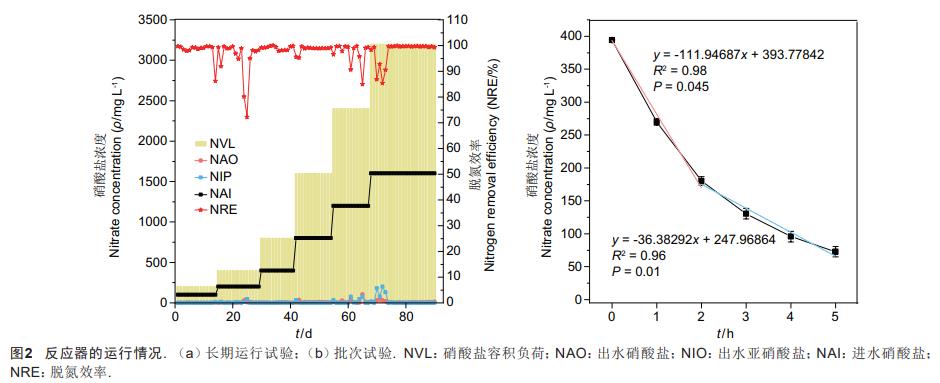
如图2b所示,取反应器长期运行最高负荷的污泥来进行批次实验,研究在长期驯化下硝酸盐的还原能力。在0h,硝酸盐浓度为393mg/L,3h剩余的浓度为180mg/L,最终还剩余72mg/L的硝酸盐。硝酸盐氮的去除分为两个阶段,即快速下降阶段(0-2h)和慢速去除阶段(2-5h),分别对0-2h和2-5h的硝酸盐浓度变化进行了线性拟合,0-2h拟合的方程式为y=-111.94687x+393.77842;2-5h拟合的方程式为y=-36.38292x+247.96864(y为硝酸盐浓度,x为时间)。从两个时间段的拟合优度判定系数R2分别为0.98和0.96来看,拟合的直线可以代表实际硝酸盐的去除速率。从拟合直线的变化来看,快速下降阶段的硝酸盐去除速率为111.95mgL-1h-1N,而慢速去除阶段的硝酸盐去除速率为36.38mgL-1h-1N。Fernandez-Nava等的研究认为在混合碳源的反硝化中,微生物首先利用容易降解的碳源快速处理硝酸盐氮,之后降解利用复杂碳源来去除硝酸盐氮,这个过程则比较缓慢,在本研究中可能与添加的不同有机酸的代谢快慢有关。
2.2 微生物群落分析
2.2.1 微生物群落的α和β多样性
α多样性是指一个群落内的物种数量及相对丰度。本研究选择采用Shannon指数来分析细菌群落的α多样性随进水硝酸盐负荷的变化情况。从图3a可以看到,污泥样品的Shannon指数值随着硝氮负荷的增加而呈现减少的趋势。微生物群落的α多样性是从低负荷就开始减少,Shannon指数值从开始的5.3(M-100-1)迅速减少到2.6(M-200-1),到阶段V后期降低到1.12.这表明该系统内的微生物种类随着硝酸盐浓度的增加而减少。
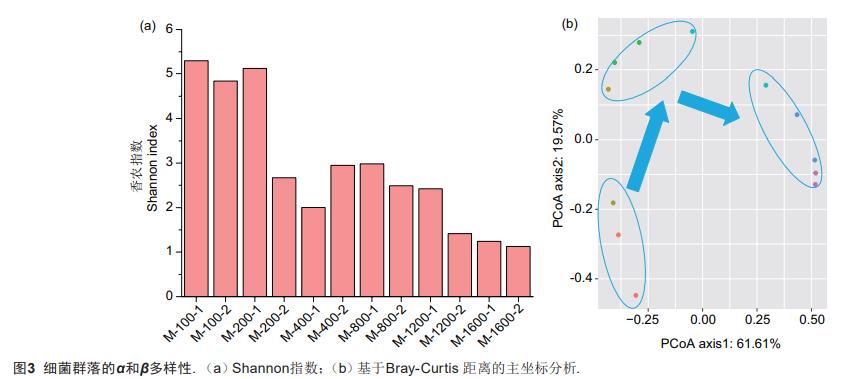
β多样性指数用以衡量群落的物种多样性沿着环境梯度变化的速率或群落间的多样性。本研究使用基于Bray-Curtis距离的主坐标分析(PcoA)来研究微生物群落结构的变化。如图3b,PCoA图的PCoA1和PCoA2轴分别解释了61.56%和2.19%的群落的变化。该系统的微生物群落结构在硝氮负荷增加过程中发生了两次明显的变化,第一次周转是在进水硝酸盐浓度为200mg/L时,第二次周转发生在进水硝酸盐浓度为800mg/L,总体呈现出了一个“U”型的周转。Lu等认为长久的NO3--N注入对细菌具有选择性,导致细菌群落结构发生改变。在该研究中两个变化的主要因素是碳源和进水硝酸浓度,由于加入的碳源始终是过量的,所以排除碳源不足对微生物的影响,即认为硝氮负荷是微生物群落结构变化的主要影响因子。
2.2.2 微生物的群落组成
为了进一步明确以混合挥发酸为碳源的反硝化系统内微生物物种组成以及丰度变化情况,对12个污泥样品的微生物群落在门和属水平上进行了类别和丰度的分析。污泥样品在门水平上(丰度为前11的门)的微生物组成及相对丰度如图4a。变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)是该系统中主要的微生物门。变形菌门的丰度从31.8%(M-100-1)增加到95.8%(M-1600-2)。拟杆菌门的相对丰度在2.5%-41%,厚壁菌门的相对丰度较低,范围为0.61%-12.1%。变形菌门和拟杆菌门一直被认为是反硝化过程中最常见的反硝化微生物,该门含有各种类型的反硝化微生物,这与其他文献的研究结果是一致的。与之相反,在该系统中有一些门的微生物,如绿弯菌门(Chloroflexi)和脱硫杆菌门(Desulfobacterota)等丰度随着硝氮负荷的增加而逐渐降低。如绿弯菌门从12.7%(M100-1)减少到0.089%(M-1600-2)。脱硫杆菌门微生物丰度在从3.7%(M-100-1)下降到0.41%(M-1600-2)。根据之前的研究,在反硝化脱氮中添加食物发酵液后,绿弯菌门的丰度增加,认为该门下的一些成员在厌氧条件下可以利用挥发酸,但本研究中随着进水硝酸盐浓度的升高,该门不再是优势的细菌门,这说明绿弯菌门的微生物不能很好地适应高氮环境。

进一步对各样品在属水平上(丰度高的前20个属)的群落结构进行分析,结果如图4b所示。首先,红环菌科(Rhodocyclaceae)是系统所有样品中最核心的微生物。红环菌科的丰度在初始样品中占比为7.8%(M-100-1),但到阶段Ⅱ(M-200-2)时,其占比达到了67.8%,并且在阶段Ⅵ(M1600-2)占比达到了最高的87.1%。此前的报道揭示红环菌科可以利用醇类、有机酸和氨基酸等碳源还原硝酸盐。并且红环菌科也被证明在稻田土壤中可以在厌氧条件下以乙酸盐为底物还原一些物质,如Fe(Ⅲ)、U(Ⅵ)、硝酸盐和高氯酸盐。还有研究揭示了红环菌科的成员,如Zoogloea、Azoarcus和陶厄氏菌(Thauera)都是主要的反硝化细菌,且在反硝化反应器中添加一定剂量的乙醇或乙酸盐会有利于这些细菌的生长。另外,陶厄氏菌和Blvii28_wastewatersludge_group也是系统中的两种核心微生物。陶厄氏菌丰度的变化范围为0.7%-27.2%。陶厄氏菌作为红环菌科的成员,是污水处理厂的涉及反硝化的核心微生物,可以利用乙酸钠和丙酸钠作为碳源进行反硝化。陶厄氏菌也是一种可以利用丁酸盐的硝酸盐还原菌,有研究使用MAR-FISH研究了探针定义的群体的底物摄取偏好,结果发现陶厄氏菌吸收了部分丁酸盐和戊酸盐。Blvii28_wastewater-sludge_group的丰度范围为0.17%-41%,在阶段Ⅰ-Ⅲ丰度很低,但在阶段Ⅳ-Ⅵ丰度增加,说明其可能是高氮中一种重要的反硝化者。在之前的研究中,Blvii28_wastewater-sludge_group常常在降解复杂化合物方面有重要作用,在丁酸盐氧化产甲烷系统中发现该种微生物与乙酸盐含量呈正相关。
另外,系统中还有一些微生物在初始样品(M-100-1)中具有一定丰度,然而,随着反应器运行,它们的丰度逐渐下降,在最终污泥样品(M-1600-2)中丰度几乎为0.所涉及的微生物菌属有SJA-28(0.014%-24.3%)、unculturedProlixibacteraceae(0-4.9%)、OLB13(0.0024%-3.8%)等。研究报道,长杆菌(Prolixibacteraceae)可以在厌氧发酵系统中使用(半)纤维素类复合物和发酵糖类,两种异养细菌(SJA-28和OLB13)可以利用有机碳源进行反硝化。然而,他们在系统中丰度下降表明这些微生物可能不适应高氮的环境。
总之,红环菌科、陶厄氏菌、Blvii28_wastewater-sludgegroup是系统中主要的功能微生物,他们在系统中高度富集,表明微生物的功能集中性增加了。不同的微生物对硝酸盐浓度的变化表现出不同的响应方式,表明硝酸盐浓度对微生物群落组成具有高度选择性。
2.2.3 影响微生物群落结构的环境因子
主要的功能微生物与环境变量的RDA如图5所示,RDA的前两轴解释了总变异的93.8%。硝酸盐负荷是影响微生物群落结构的最重要的环境因子,其次是pH。其中,红环菌科和Blvii28_wastewatersludge-group与硝酸盐负荷和pH呈正相关,陶厄氏菌与硝酸盐负荷和pH呈负相关。这说明随着负荷的提高,作为主要的功能微生物,红环菌科和Blvii28_wastewater-sludge-group比陶厄氏菌更能抵抗高硝酸盐环境。

2.2.4 功能基因nosZ的变化
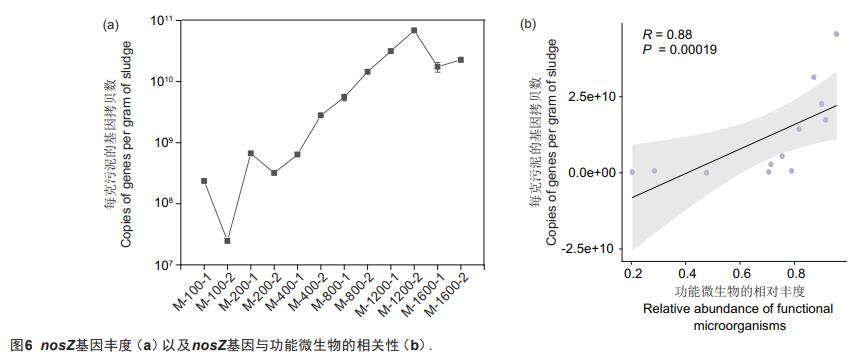
N2O是主要的温室气体之一,会导致全球气温升高。反硝化中,这一步骤(N2O→N2)是由nosZ基因编码的N2O还原酶来催化的。因此,本研究通过定量污泥样品中的nosZ基因,来研究添加混合挥发酸作为碳源的反硝化过程中N2O的排放情况。如图6a所示,该系统的nosZ基因拷贝数(copies/MLSS)变化范围为2.48×107-6.85×1010g-1.系统的nosZ基因拷贝数总体随着硝氮负荷的增加而增加。然而,拷贝数存在着3次显著下降,分别发生在样品100-2、200-2和1600-1中,这正好与长期反应器试验中系统发生波动的时期一致。这说明微生物受到环境的影响时其丰度会相应减少,从而影响其脱氮效率。
进一步,采用Manteltest分析nosZ基因拷贝数与主要功能微生物的相关性(主要功能微生物红环菌科、陶厄氏菌和Blvii28_wastewater-sludge-group丰度之和)。如图6b所示,该系统的nosZ基因拷贝数与功能微生物的相关性R值为0.88,P值为0.00019,说明该系统的nosZ基因拷贝数与功能微生物之间具有显著的正相关性,表明系统中加入的硝酸盐可被这3种功能微生物代谢的终产物可能是N2。
2.3 宏基因组分析
样品(M-1600-2)被用于宏基因组测序,共获得12.02G的原始数据。利用KEGG代谢数据库对整个代谢途径进行分析。图7a显示了kegg3级通路上富集的一些功能。丰度排名前6的功能有代谢通路(metabolicpathways,ko01100)、次级代谢物的生物合成(biosynthesisofsecondarymetabolites,ko01110)、多样环境中的微生物代谢(microbialmetabolismindiverseenvironment,ko01120)、双组分系统(twocomponentsystem,ko02020)、辅助因子的生物合成(biosynthesisofcofactors,ko01240)和碳代谢(carbonmetabolism,ko01200)。代谢通路(ko01100)相对丰度为16.6%,显著高于其他通路。另外,氮代谢(nitrogenmetabolism,ko00910)通路的相对丰富为0.71%。

进一步对碳、氮代谢过程中涉及的模块进行分析。如图7b所示,氮代谢中涉及的模块主要有氮固定(M00175)、硝酸盐同化还原(M00530)、硝酸盐异化还原(M00531)、硝化(M00528)、反硝化(M00529)和全程硝化(M00804),他们的相对丰度分别为0.0065%、0.60%、0.20%、0.00026%、0.6822%和0.28%。可以看出,该系统中的氮代谢主要集中在反硝化反应和硝酸盐同化还原。M00009(2.6%)是TCA循环的模块,代表着乙酸的代谢过程。M00741(0.22%)和M00013(0.20%)两个模块是参与丙酸盐代谢的两个模块,M00087(1.28%)、M00088(0.75%)和M00027(0.13%)是丁酸盐代谢相关的模块。由此可以看出,在该系统更多的是发生乙酸盐代谢,然后是丁酸盐代谢。从图7d也可以看出,出水中剩余最多的是乙酸,然后是丙酸,也就是说相对于丙酸,丁酸更优先被利用了。研究表明相对于丁酸和丙酸,乙酸更优先被利用。乙酸被直接氧化并转化为乙酰辅酶A,丁酸和丙酸同样都是代谢为乙酸才被微生物利用,但是丁酸经过β氧化为乙酸,丙酸则是合成丁酸发生歧化反应或者先生成丙酰COA转化成乙酰,代谢过程更复杂。本研究选择的C/N为6.86,低负荷的出水中并未检测到剩余的挥发酸,排除机器灵敏度低造成的误差,1200和1600mg/L负荷的高有机酸残留率的原因可能有两个:首先,本来添加的碳源是过量的,负荷越高剩余越多。另外,在低负荷时存在的微生物种类较多,除了反硝化者,还有一些非反硝化者,它们可能也利用有机酸满足生长,随着进水硝酸盐负荷的增加,非反硝化者和部分反硝化者被淘汰掉,用于生长所需要的碳源也会减少。
氮代谢过程是由多种酶参与的,图7c展示了涉及反硝化的功能基因的相对丰度。在反硝化过程中,编码关键酶的基因主要有narG和narA(NO3-→NO2-)、nirS和nirK(NO2-→N2O)、norB(N2O→NO)和nosZ(NO→N2)。该系统具有最高的narG基因丰度,其次是nosZ基因。nosZ(31.86%)基因在反硝化基因中所占的丰度显著高于nirS(5.37%)、nirk(0.18%)和norB(11.35%)基因,表明添加混合挥发酸在减少N2O排放方面可能有重要意义。另外可以看到,同样作为亚硝酸盐还原的基因,nirS的丰度显著高于nirK,这表明nirS型微生物在亚硝酸盐还原中可能具有更重要的作用。也有其他研究表明在大多数废水处理系统中nirS基因相对丰度高于nirK基因。
3、结论
添加混合有机酸作为反硝化碳源的系统具有高效稳定的脱氮效率,最大的反硝化速率为111.95mgL-1h-1。微生物的α多样性显著降低,微生物群落均朝一定方向周转,并且功能微生物高度富集,说明系统功能集中性增强。另外,系统在长期驯化中富集了高丰度的反硝化代谢模块,且高度富集了反硝化功能基因nosZ,这对于减少温室气体排放可能有着重要的意义。综上结果来看,混合有机酸作为反硝化脱氮的碳源具有一定的可行性,系统内功能微生物高度富集,脱氮性能稳定,出水指标合格,还可以节约成本,可以考虑用于实际的污水处理。但本研究也存在一些局限性,只是用人工合成的混合有机酸来代替食物发酵液中的挥发酸,而实际的挥发酸成分复杂,对微生物可能存在其他方面的影响。另外缺少对气体数据(N2)的监测,故关于使用混合挥发酸作为碳源在可以减少N2O排放方面还缺少有力证据。后续可以将功能微生物红环菌科分离出来,明确其功能;并使用真实的食物发酵液作为碳源,完善监测指标,根据处理效果明确食物发酵液作为反硝化碳源的优势。(来源:福建农林大学资源与环境学院,中国科学院成都生物研究所,核工业西南勘察设计研究院有限公司)
