基于亚硝化的全程自养脱氮(CANON)工艺是一种新型的单级自养生物脱氮技术。与传统生物脱氮工艺相比,其在低碳氮比(C/N)废水治理中具有诸多优势。近年来,随着CANON工艺应用范围的扩大,相继有学者尝试利用此技术脱除城镇生活污水中的氮素。然而,由于城镇生活污水的水温通常低于25℃,其中的NH4+-N含量普遍偏低且水质波动较大,CANON工艺对此类废水的脱氮效果不尽人意。经分析可知,当CANON工艺处理城镇生活污水时,其中的短程硝化作用易因亚硝酸盐氧化菌(NOB)过量增殖而失稳,从而导致系统脱氮性能常呈恶化状态。
CANON反应体系依赖于好氧氨氧化微生物和厌氧氨氧化菌(AnAOB)的高效协同,其中,短程硝化(NH4+-N→NO2--N)可为厌氧氨氧化(ANAMMOX)反应提供电子受体——NO2--N,故该过程的实现是确保CANON工艺顺利运行的前提。为此,当CANON工艺应用于城镇生活污水治理时,需保障系统中短程硝化和ANAMMOX反应之间的平衡。由当前研究可知,溶解氧(DO)调控被认为是实现城镇生活污水短程硝化的有效途径,但有研究指出,当装置运行温度低于25℃时,无论何种曝气模式均不能有效实现此类污水的短程硝化,NOB增殖无法得到有效抑制。
随着生物电化学工艺日益应用于污水脱氮领域,微生物电化学氨氧化技术不断发展。目前已有文献发现,生物电化学系统(BES)中可发生电极氨氧化反应,即电活性生物膜能以阳极为电子受体将NH4+-N氧化并产能。作者前期研究证实,在特定运行条件下,BES中培育的电活性生物膜可通过电极氨氧化作用实现NH4+-N的厌氧氧化与NO2--N的累积,此发现为NO2--N的稳定获取提供了新思路;另一方面,生物电化学技术还可提高AnAOB的丰度与活性,利于该菌群与相关电活性微生物之间实现协作。鉴于此,在前期研究基础上,如能借助生物电化学强化措施将电活性氨氧化微生物与AnAOB耦合,进而构建基于电极氨氧化的全程自养脱氮反应体系,则可弥补CANON工艺在处理城镇生活污水时存在的短程硝化难实现且稳定性差的缺陷。然而,基于电极氨氧化的全程自养脱氮系统的构建方式及启动性能目前尚待探究,其中的耦合机制亦不明晰。
本研究以电极氨氧化型序批式生物膜反应器(SBBR)为试验装置,接种ANAMMOX污泥后将其置于常温下处理模拟城镇生活污水,随后以外加阳极电势调控为主要手段尝试构建了基于电极氨氧化的全程自养脱氮系统,并对系统的启动性能及微生物学特征进行了探究;其间,着重考察了不同外加阳极电势下系统脱氮产电性能的变化,解析了相应条件下系统中的微观生物学特征。本研究旨在为新型生物脱氮工艺的研发及设计提供参考。
1、材料与方法
1.1 实验装置
以SBBR为实验装置,根据实验需要将其划分为4组,包括1组试验组(标记为R1)和3组对照组(标记为R2、R3和R4)。如图1所示,R1由不锈钢制成,其内径和有效容积分别为10cm和2.0L;装置阳极(工作电极)取自氨氧化型BES,材质为石墨毡,其长度、宽度和厚度分别为20cm、20cm和3mm,表面附着电活性氨氧化生物膜,此工作电极在试验期间被卷成圆筒状并安装在R1中;阴极(对电极)为不锈钢池体;参比电极设为饱和甘汞电极(SCE)且被安装于阳极附近。将上述3电极分别通过导线与恒电位仪(上海昕瑞,DJS-292C)相连。实验伊始,将30mL的ANAMMOX污泥接种至R1中,而后开展后续研究。对于3组对照组,R2被设置为非生物对照组,其与恒电位仪相连,但其阳极(尺寸同上)表面无生物膜,装置中也未接种ANAMMOX污泥。此外,R3与恒电位仪相连,其阳极(尺寸同上)同样未附着生物膜,但装置中接种了30mL的ANAMMOX污泥;R4的阳极类型与R1一致,装置中也接种了30mL的ANAMMOX污泥,但其外电路为断路状态。
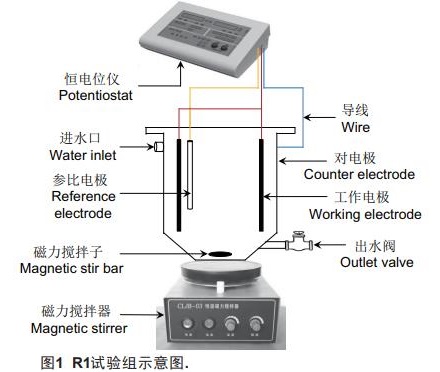
1.2 运行条件
各组SBBR每天运行4个周期,每个周期时长6h,包含进水阶段、反应阶段、排水阶段和闲置阶段,4个阶段的时长分别为15、330、10和5min。其中,在进水阶段和闲置阶段分别向各装置中吹入高纯氦气以保障其厌氧环境,另利用恒电位仪调控R1、R2和R3在反应阶段的阳极电势(vs。SCE)。此外,实验期间各装置中的水温维持在14-23℃。
本研究共持续了214个周期,其间R1、R2和R3共经历了6个试验阶段(依次标记为a、b、c、d、e和f),其外加阳极电势对应设为0.00、0.30、0.50、0.60、0.80和0.60V。
1.3 接种生物膜(污泥)与进水水质
R1和R4中附着有电活性氨氧化生物膜的石墨毡均取自已成功启动的氨氧化型BES。在前期试验中,当氨氮浓度设为50.87(±2.54)mg/L且外加阳极电势恒定为0.50V时,氨氧化型BES的NH4+-N氧化率(AOE)、NO2--N累积率(NiAE)和NO3--N累积率(NaAE)分别为99.33%(±0.11%)、88.08%(±2.07%)和2.25%(±0.42%)。此外,接种至R1、R3和R4中的ANAMMOX污泥购于福建省三明市某ANAMMOX中试系统,为絮状和颗粒状混合污泥,其MLSS约9500mg/L,分析发现,种泥中含有的AnAOB主要为隶属于浮霉菌门(Planctomycetota)的CandidatusBrocadia。
各组装置进水为模拟废水,由50mmol/L的磷酸盐缓冲液(pH=7.5)配制而成。在配置模拟废水时,先将上述缓冲液进行高压蒸汽灭菌(T=121℃,t=20min),冷却后再添加NH4Cl(0.19g/L),以便使其中的NH4+-N浓度维持在50(±5)mg/L(即相当于城镇生活污水中NH4+-N的浓度)。模拟废水在注入SBBR之前,需通入高纯氦气(t=20min)以除去其中的DO。
1.4 分析方法
1.4.1 水样和生物膜样品的采集
每周期采集各组装置的进出水水样,样品设置3个平行;分别在本研究的第37、63、91、127、155和213个周期开展R1中生物膜样品的采集工作,获取的6组生物膜样品对应标记为S1、S2、S3、S4、S5和S6。
1.4.2 水样分析方法
依照文献中方法测定水样中TN、NH4+-N、NO2--N和NO3--N的含量,用WTW-Multi 340i型便携式水质分析仪原位检测各装置中的水温和DO浓度。
1.4.3 电流密度测定
各装置的电流密度(J)可根据公式J=//A计算获得,其中,/为电流值(μA),由恒电位仪测得;A为工作电极投影面积(cm2)。
1.4.4 胞外聚合物测试方法
依照碱提取法对生物膜样品的胞外聚合物(extracellularpolymericsubstances,EPS)进行提取。EPS中多糖含量的测定参照苯酚-硫酸法,标准物质为葡萄糖;EPS中蛋白质含量的测定参照考马斯亮蓝法。
1.4.5 功能酶活性测试方法
依照文献中方法对生物膜样品进行预处理,而后提取其中的细胞色素c(Cyt-c)、亚硝酸还原酶(Nir)、肼合成酶(HZS)和肼脱氢酶(HDH),并利用酶标仪测定4种功能酶的活性。
1.4.6 DNA提取与高通量测序
对各生物膜样品中的DNA进行提取纯化。产物检测合格后对其进行扩增,并对扩增后的PCR产物进行完整性检测。本研究选择16SrDNAV3+V4可变区片段进行PCR扩增,引物序列为341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)。扩增后PCR产物经纯化、定量和均一化形成测序文库,建好的文库随后用Qsep-400方法进行质检,最后由百迈客生物科技股份有限公司基于IlluminaNovaSeq6000平台进行高通量测序。测序分析后,根据Barcode序列区分各个样本的数据,进行嵌合体过滤,得到可用于后续分析的有效数据,即Cleanreads。为了研究样品的物种组成多样性,对所有样品的Cleanreads进行聚类,以97%的一致性(identity)将序列聚类成OTUs(operationaltaxonomicunits),然后对OTUs的代表序列进行物种注释。
1.5 数据处理
采用SPSS28.0对实验数据进行统计分析;采用OneWayANOVA进行方差分析;采用Origin2018作图;参照文献对反应装置的污染物去除率、转化率和累积率等进行计算。
2、结果与分析
2.1 运行性能
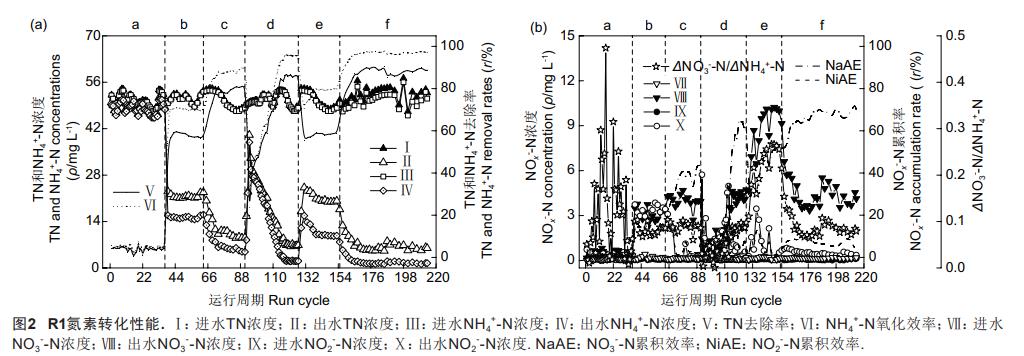

由图2和图3可知,R1的脱氮性能受外加阳极电势影响。当外加阳极电势为0.00V时,R1的脱氮性能在a阶段不理想,其TN去除率(TNRE)与AOE均低于5%。随着外加阳极电势的提高,R1的脱氮性能逐渐得以优化。当外加阳极电势为0.50V时,R1的TNRE和AOE稳定在79.67%(±1.39%)和88.04%(±1.32%),典型周期内系统中NO3--N的生成量(ΔNO3--N)与NH4+-N的减少量(ΔNH4+-N)之比为0.08(±0.01)。据此分析,在特定阳极电势下,R1中的电极氨氧化应与ANAMMOX发生耦合,形成了类似CANON工艺的单级自养脱氮系统,且该体系中的氮素转化特征也与CANON反应类似。值得注意的是,在上述3个阶段,R1中的DO浓度始终低于0.10mg/L。在d阶段初,因恒电位仪故障导致R1的外加阳极电势出现波动,系统运行性能随之恶化:在第94个周期,R1的TNRE和AOE骤降至19.79%(±1.95%)和23.61%(±3.39%),该结果表明R1中全程自养脱氮作用的进行依赖于适宜电势的稳定施加,当外加阳极电势波动时,R1中的电极氨氧化反应无法正常发生,使得NH4+-N氧化过程受阻,影响了系统的脱氮性能。而后恒电位仪修复并持续向R1提供0.60V的外加阳极电势,系统脱氮性能逐渐恢复,其TNRE和AOE自第114个周期后稳定在85.30%(±1.54%)和94.83%(±1.49%),期间典型周期内系统的ΔNO3--N/ΔNH4+-N为0.08(±0.06),装置中的DO浓度仍低于0.10mg/L。在e阶段,将阳极电势进一步提高到0.80V,R1的TNRE和AOE分别降至59.22%(±3.45%)和78.28%(±3.26%),此时装置出水中的NO3--N出现累积,浓度达8.72(±1.69)mg/L,同时R1中的DO浓度增至0.85(±0.26)mg/L。在电解水的过程中,析氧反应发生时的标准电极电势E0(H2O/O2)应需达到+1.23V(vs。SHE,pH=0),而如有微生物的催化作用,E0(H2O/O2)可降至+0.80V(vs。SHE,pH=7)。据此推断,0.80V的阳极电势可能导致R1的工作电极表面发生析氧反应,致使系统脱氮效果恶化。为保障R1的脱氮性能,在f阶段再次将阳极电势降至0.60V,期间R1中的DO浓度降至0.10mg/L以下,系统的TNRE和AOE分别稳定在88.36%(±1.50%)和96.96%(±0.54%)。本研究同时测定了R2、R3和R4的运行性能。其中,3组装置的TNRE与AOE均低于1%,且其中的DO含量在试验期间均小于0.07(±0.02)mg/L,由此证实R1中的电极氨氧化反应和析氧作用均是相关微生物催化所致,且电极氨氧化的发生是确保后续ANAMMOX反应高效进行的前提。
2.2 电流密度变化

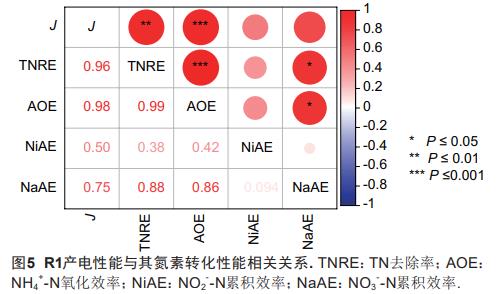
由图4可知,随着R1外加阳极电势的变化,该系统在各周期的电流密度峰值对应出现波动。其中,R1的电流密度峰值在外加阳极电势为0.60V时可达545.08(±5.03)μA/cm2.分析可得,R1的输出电流密度与其TNRE、AOE、NiAE和NaAE均呈正相关关系(图5),且与AOE的相关性(0.98***,P≤0.001)最高。据此断定,R1的产电性能在很大程度上受制于电活性微生物对NH4+-N的厌氧氧化过程。
2.3 EPS含量及成分变化

对6组生物膜样本中的EPS含量及成分进行了测定,结果如图6所示。当外加阳极电势由0.00V增至0.60V时,对应生物膜样本中的EPS含量由234增至560mg/g(以VSS计);随着外加阳极电势进一步增至0.80V,S5中的EPS含量出现下降,为518mg/g;而后将外加阳极电势稳定在0.60V后,取自f阶段末的S6中的EPS含量稳定在554mg/g。其中,S4和S6中的EPS含量均高于其他4组样本。由此判断,特定范围阳极电势的施加会提高R1中电活性微生物的EPS分泌量,应能促进相关功能微生物在阳极表面生长和富集,并利于其活性的提高;此外,EPS的多层结构还会阻止某些有毒物质进入微生物体内,有助于微生物抵御外界环境变化带来的不利影响。另一方面,对于提取自S4和S6的EPS,其中蛋白质(proteins,PN)含量较其他样本有显著提高,且2组样本EPS中PN与多糖(polysaccharides,PS)含量的比值(PN/PS)分别可达1.32和1.30,亦高于S1(0.75)、S2(0.77)、S3(0.92)和S5(1.10)。该结果表明,对R1施加特定范围的阳极电势可增加其EPS中蛋白质的含量,进而可提高PN/PS。考虑到蛋白质比例升高会增强细胞表面的疏水性,PN/PS的增大进一步证实微生物更易在R1的工作电极表面附着和聚集。
2.4 微生物多样性及其群落结构特征
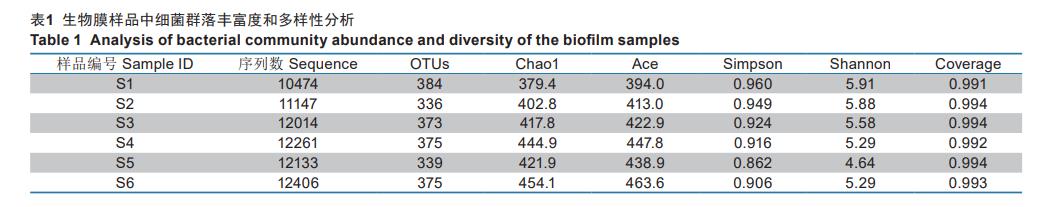
对采集的6组生物膜样本进行测序后,共获得80353条高质量序列,聚类划分后共产生496个OTUs。利用多样性分析(α)来反映各生物膜样本中微生物群落丰度和多样性,α多样性指数的统计如表1所示。表1表明,6组样品测序的样本文库覆盖度(coverage指数)均大于0.99,表明测序对样品覆盖度高,能较好地反映样品的真实情况。另由表1可知,随着外加电势由0.00V增至0.60V,样本的Chao1指数和Ace指数逐渐升高,由379.4和394.0分别增至444.9和447.8;与此同时,样本的Simpson指数和Shannon指数却逐步下降,由0.960和5.91分别降至0.916和5.29.随着外加电势进一步增至0.80V后,样本的Chao1指数、Ace指数、Simpson指数和Shannon指数分别降至421.9、438.9、0.862和4.64.Chao1指数和Ace指数是衡量微生物群落丰富度的两项指标,其数值越大,表明群落的丰富度越高,而Shannon指数和Simpson指数则可用来评估群落的丰富度和群落均匀度,两者的数值与群落多样性成正比。由上述结果判断,适宜强度阳极电势的施加有助于提高系统中部分功能微生物的丰度,并可产生定向驯化效应,导致微生物群落的多样性降低;而当阳极电势过高时,装置中微生物的生长代谢均不同程度地受到抑制,致使样品中微生物群落的丰度与多样性均下降。
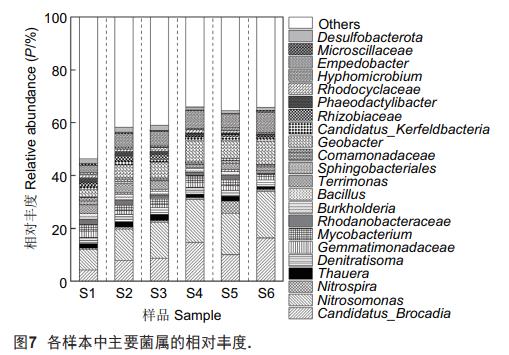
各生物膜样本的微生物群落结构如图7所示。S1中的优势菌属包括Nitrosomonas、CandidatusBrocadia、Empedobacter和Geobacter,其相对丰度分别为7.84%、4.25%、2.80%和2.74%。其中,Nitrosomonas隶属AOB,是参与短程硝化过程的功能菌属;CandidatusBrocadia隶属AnAOB,可主导ANAMMOX反应,Empedobacter和Geobacter则是BES中常见的两种功能菌属。随着外加阳极电势逐步提升至0.60V,上述4种菌属在生物膜样本中的占比随之提高。对于S4,其中Nitrosomonas、CandidatusBrocadia、Empedobacter和Geobacter的相对含量分别增至16.39%、14.64%、6.82%和8.10%。而后在0.80V的外加阳极电势下,S5中Nitrosomonas(15.69%)、CandidatusBrocadia(10.09%)、Empedobacter(5.23%)和Geobacter(6.88%)的相对丰度较S4出现了不同程度的降低,但该样本中Nitrospira(4.53%)的相对含量却明显增加。Nitrospira隶属NOB,为参与生物硝化过程(即NO2--N→NO3--N)的功能菌属,此菌属占比的提高应归因于0.80V阳极电势下电极表面的析氧反应。将f阶段的外加阳极电势再次设置为0.60V后,S6中Nitrosomonas、CandidatusBrocadia、Empedobacter、Geobacter和Nitrospira的百分含量最终稳定在17.67%、16.28%、7.59%、8.84%和0.78%。
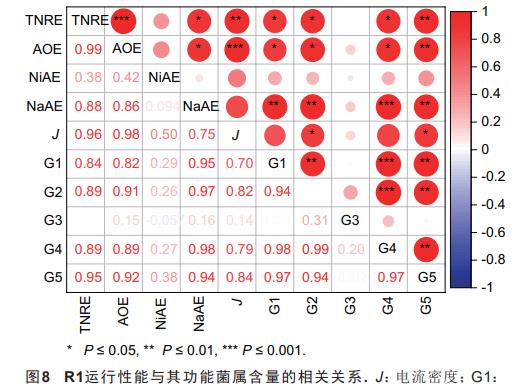
另由图8可知,R1的脱氮性能与系统中4种功能菌属(即Nitrosomonas、CandidatusBrocadia、Geobacter和Empedobacter)的相对丰度均呈正相关关系。其中,系统的TNRE和AOE分别与其中的Nitrosomonas含量呈极显著相关关系(0.95**,P≤0.01;0.92**,P≤0.01);同时,此两项指标与其他3种功能菌属的相对丰度亦呈显著正相关。另值得注意的是,R1的输出电流密度与系统中Nitrosomonas和Empedobacter的含量呈显著正相关关系(0.84*,P≤0.05;0.82*,P≤0.05),结合2.2中结果推测,Nitrosomonas和Empedobacter参与下的NH4+-N氧化过程可显著影响R1的产电性能。
2.5 AnAOB活性变化
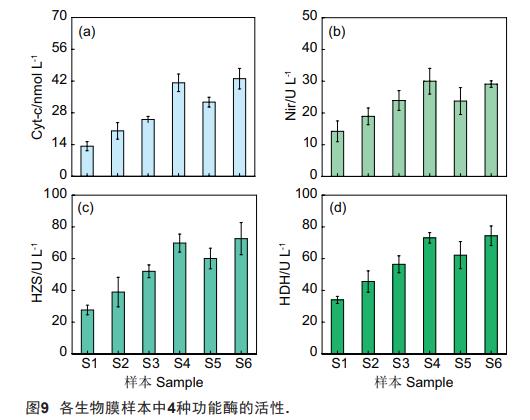
在ANAMMOX过程中,参与反应的功能性酶主要有Nir、HZS、HDH和Cyt-c,前3种功能酶可分别催化ANAMMOX反应中NO2-向NO的转化过程、NO和NH4+生成N2H4的过程以及N2H4的分解过程,而Cyt-c则在反应过程中起到了电子传递的作用。考虑到AnAOB为各组SBBR中主要的功能微生物,分别测定了各生物膜样本的功能酶活性(图9)。从中可知,与AnAOB在生物膜样本中的相对含量变化相呼应,S4和S6中4种功能酶的活性均不同程度地高于其他4组样本。其中,S4和S6中Cyt-c的浓度为41.22(±3.86)和43.05(±4.53)nmol/L,分别约为S1、S2、S3和S5的3.10和3.24倍、2.06和2.15倍、1.64和1.72倍、1.26和1.32倍。同时,S4和S6中Nir、HZS和HDH的活性亦均高于S1、S2、S3和S5.分析可得,特定阳极电势的施加不仅提高了装置中AnAOB的相对丰度,也不同程度地增强了参与ANAMMOX过程的4种关键酶的活性,从而在整体上提升了ANAMMOX反应的速率,使得底物(即NH4+-N和NO2--N)转化速率增大。与S4和S6相比,S5中4种功能酶的活性及AnAOB的相对丰度有所下降,此结果很大程度上应归因于0.80V阳极电势下R1中的析氧反应,即此条件下DO浓度的升高以及NOB的过量增殖影响到了AnAOB的生长与代谢,进而对其活性和丰度产生了抑制。
3、讨论与结论
作为当前备受关注的一种生物脱氮技术,ANAMMOX工艺在处理城镇生活污水时面临着反应基质(即NO2--N)难以稳定获取、AnAOB活性偏低两大“瓶颈”问题。随着生物电化学脱氮技术的发展,电极氨氧化反应的发现为破解上述难题提供了新思路。电极氨氧化作用在厌氧条件下可实现污水中NH4+-N的氧化与NO2--N的稳定积累,避免了NOB的过度增殖,亦降低了工艺操作难度。本研究基于电极氨氧化装置,借助接种ANAMMOX污泥和调控外加阳极电势等手段成功构建了基于电极氨氧化的全程自养脱氮系统,在常温下实现了系统中NH4+-N的厌氧氧化与TN的高效脱除,从而弥补了基于短程硝化的ANAMMOX技术的缺陷,为城镇生活污水高效脱氮开辟了新途径,亦有助于新型生物脱氮工艺的研发与设计。
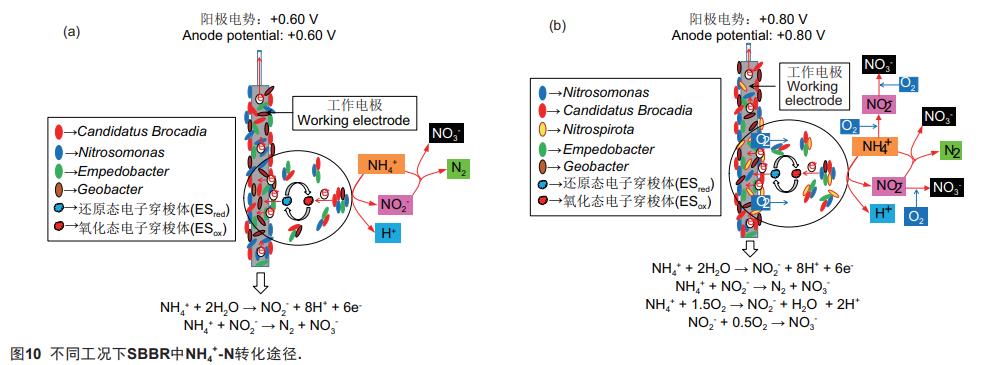
上述结果表明,对于施加了生物电化学措施且接种了ANAMMOX污泥的R1,该系统虽以厌氧环境为主,但在特定外加电势下,电极氨氧化可与ANAMMOX发生耦合,形成基于电极氨氧化的全程自养脱氮反应体系,进而可实现氮素的高效脱除。当外加阳极电势为0.60V时,R1能获得理想的AOE和TN去除率。实验期间Nitrosomonas、CandidatusBrocadia、Geobacter和Empedobacter是参与R1中基于电极氨氧化的全程自养脱氮反应的功能菌属。其中:(1)Nitrosomonas主导了装置中NH4+-N的转化。作为一类化能自养菌,Nitrosomonas可在好氧条件下氧化NH4+-N为NO2--N。然而,有研究(包括作者前期实验)已证实,BES中的Nitrosomonas在厌氧环境下能以阳极为电子受体将NH4+-N氧化为NO2--N,则该菌属可通过电极氨氧化反应实现R1中NH4+-N的转化与NO2--N的累积。另一方面,Geobacter也应参与了NH4+-N的厌氧氧化。作为一类典型的电化学活性菌,Geobacter具有氨氧化的相关功能基因,能参与BES中的电极氨氧化反应,故断定R1中的Geobacter有助于系统中NH4+-N的转化;(2)CandidatusBrocadia通过ANAMMOX反应实现了系统中TN的脱除。如前所述,CandidatusBrocadia为一类厌氧氨氧化微生物,其可在缺氧条件下以NO2--N为电子受体,氧化NH4+-N为N2和小部分的NO3--N,则该菌属可通过与Nitrosomonas协作实现脱氮。期间,CandidatusBrocadia的活性及丰度亦可在电场作用下得以提高;(3)Empodebacter提高了电极氨氧化作用的强度。作为一类化能异养菌,Empodebacter与Nitrosomonas之间应存在互生关系,即Nitrosomonas在氧化NH4+-N时产生的有机物可供Empodebacter利用,而Empodebacter在代谢过程中能分泌黄素类化合物,鉴于黄素类化合物可作为电子穿梭体介导微生物胞外电子传递,则Empedobacter可采用分泌内生电子穿梭体的手段协助Nitrosomonas完成电极氨氧化反应,并在一定程度上提高了电活性生物膜的电子传递效率。由上述结果还可知,过高的阳极电势并不利于R1高效脱氮。在0.80V的阳极电势下,系统的TN去除率及AOE分别降为59.22%(±3.45%)和78.28%(±3.26%),且其出水中的NO3--N出现累积,推测此时基于电极氨氧化的全程自养脱氮作用遭到了削弱,从而恶化了系统的脱氮效果,而该结果可能归咎于:(1)阳极表面的析氧反应使系统中的厌氧环境被破坏,导致DO浓度升高与Nitrospira过量增殖,使装置中的部分NO2--N进一步氧化为NO3--N,进而改变或抑制了相关功能微生物(如Nitrosomonas、CandidatusBrocadia等)的代谢途径及活性;(2)阳极附近的电解水反应因过高的外加电势而增强,造成该区域pH值发生剧变,由此对功能微生物的活性产生了负面影响;(3)在过高的阳极电势条件下,电活性生物膜中功能微生物的细胞膜发生了不可逆穿透或其胞体组分的直接氧化,致使其代谢活性下降。基于上述推论,特定工况下R1中NH4+-N可能的转化途径如图10所示。
需注意的是,目前仍未有证据明确证实Nitrosomonas具备胞外电子传递的能力,则电极氨氧化作用的反应机理应在后续研究中进一步探索。另一方面,鉴于ANAMMOX反应特点,R1的TN去除率始终≤89%且其出水中含有一定量的NO3--N,后续研究还应探寻相关措施实现NO3--N的高效脱除,以便强化系统的脱氮效能。(来源:安徽农业大学资源与环境学院,安徽新华学院城市建设学院,山东省环境保护科学研究设计院有限公司)
