随着工业社会的迅猛发展,水资源污染问题日益严重,严重威胁了人类的生存与健康。一般工业废水中含有大量的人工合成有机物,如芳烃、多环芳烃、氯代芳烃、有机酸酯等。这些有机物污染物不仅难以生化降解,而且进入环境系统后会沿着食物链生物富集,最终影响人类的神经系统、内分泌系统、生殖功能等。因此,水中难降解有机物的污染问题已成为水资源治理面临的一项严峻挑战。
臭氧高级氧化技术(Advanced oxidation processes-O3,AOP-O3),作为一种绿色高效的水处理技术,因其可以通过臭氧分解产生强氧化活性的氧自由基(·OH、·O2-、1O2)而受到广泛的关注。其中比较常见的有以下几种:(1)单独臭氧氧化(O3);(2)紫外/臭氧氧化(UV/O3);(3)过氧化氢/臭氧氧化(H2O2/O3);(4)金属催化臭氧氧化。
本文主要介绍了臭氧高级氧化技术在有机物降解中的应用及研究现状,并对其催化机理进行分析,指出未来臭氧类高级氧化技术的主要发展方向。
1、臭氧高级氧化的原理
标准状态下臭氧具有较高的氧化电位(2.07V),是一种常见的氧化剂。臭氧在水中分解后产生比臭氧更强的氧化性物质,如羟基自由基(·OH)等,可以有效地去除水中有机污染物。Staehelin等在前人研究的基础上提出了水体中的臭氧分解机理,如图1所示。臭氧在水中的分解反应为自由基链式反应,引发该链式反应的物质主要有两种:由水中OH-引发臭氧分解产生HO2·和·O2-;由水中杂质M(如某些金属离子)引发臭氧分解产生HO3·、·OH、O3-。氧化能力较弱的·O2-可以迅速与臭氧反应,促进水中臭氧分解产生·OH。羟基自由基(·OH)作为一种无选择性的强氧化剂,与有机物分子氧化反应的反应速率常数可达106~109L·mol-1·s-1,许多难生化降解的有机污染物均可通过·OH的氧化作用有效去除。
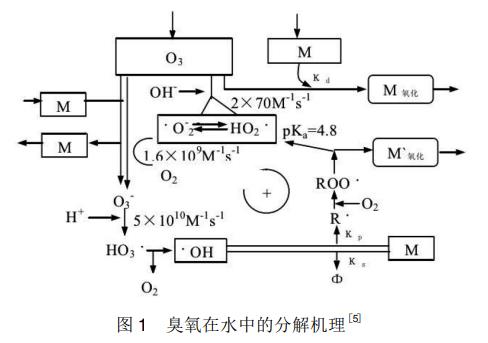
2、臭氧高级氧化技术在废水处理中的研究进展
2.1 单独臭氧氧化(O3)技术
臭氧一直以清洁高效而著称,在水处理方面的应用已有一个多世纪的历史。单独臭氧氧化处理有机物时,是以臭氧分子与有机物之间的直接氧化为主导。这种处理方法虽然高效无污染,但也存在一些明显的不足之处。臭氧与不同有机物反应时的反应速率常数相差较大(如表1所示),即臭氧氧化具有选择性,使得废水中的COD和TOC很难被彻底去除。因此,臭氧类高级氧化技术一般通过与其他技术联合使用来促进臭氧分解产生高活性的·OH,从而增强有机物的去除效果。
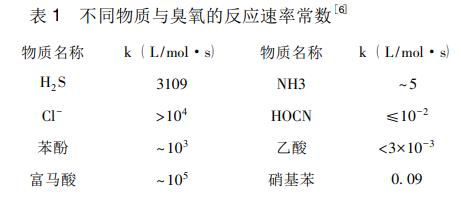
2.2 紫外/臭氧氧化(UV/O3)技术
UV/O3技术将紫外与臭氧结合,利用紫外辐射产生的能量使得臭氧分解产生大量的·OH,从而提高有机物的去除效果。Ku等以难生化降解的酚类物质为目标有机污染物,通过UV/O3氧化体系处理明显增加了苯酚的降解速率。在该实验条件下,3h内苯酚的矿化率可以达到98%以上。Xu等使用了UV和UV/O3两种技术方法,分别对亚硝基二乙胺(NDEA)的降解效果及途径进行了研究。结果表明这两种方法均可以有效地去除NDEA。通过对不同初始溶液pH的探究发现,在UV/O3过程中溶液体系的pH值对NDEA的降解速率几乎没有影响。同时对NDEA的降解机理进行研究,发现单独UV过程主要是通过紫外线照射使N-N键裂变;而UV/O3过程则主要是通过产生·OH与NDEA发生反应。
随着对UV/O3体系的不断深入研究,研究者也提出了较为详细的催化机理,如图2所示。UV/O3体系催化降解有机物主要通过·OH的作用完成,其过程可以分为两个阶段。第一阶段,溶解在水中的臭氧发生光解产生H2O2,H2O2在紫外光照的作用下直接分解产生·OH,这是该阶段产生·OH的主要方式。上述方式产生的·OH进入第二阶段的自由基反应循环,同时水中的有机污染物也参与该循环反应,促进有利于臭氧分解的O2-生成。此时O2-对臭氧的分解是产生·OH的主要方式。
UV/O3技术虽然具有很强的氧化能力,但由于其处理费用较高,操作工艺复杂,一般只是在实验室作为基础研究。目前研究比较热门的是将UV/O3技术与TiO2、ZnO等一系列光催化材料结合起来,在提高降解效率的同时可以降低处理费用。
2.3 过氧化氢/臭氧氧化(H2O2/O3)技术
H2O2作为一种常见的氧化剂也经常被用于臭氧高级氧化技术中。张莹莹等采用O3和H2O2/O3两种方法对制浆造纸废水处理进行了研究。结果表明,这两种方法对废水色度的去除均有显著的效果。相同条件下,通过H2O2/O3方法处理废水可以使废水的COD去除率增加20%。Pobernik等以甲基异噻唑酮类物质为模拟废水,通过O3和H2O2/O3两种手段降解有机物,并利用生态参数对两种降解方法进行评估。研究发现使用H2O2/O3方法处理后,有机物去除率为99%以上,COD和TOC的去除率分别达到91%和44%,可以有效增加有机物的矿化度。
H2O2/O3的作用机理与OH-/O3相似,H2O2去质子化后产生HO2-,HO2-与臭氧作用产生高活性的·OH以及可以促进臭氧分解的O2-。其机理过程可用如下反应方程式来描述:
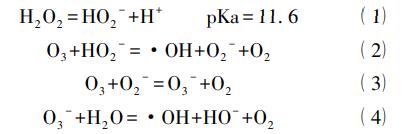
H2O2/O3体系对有机物的降解效率显著,且H2O2分解后不产生新的污染物,是一种绿色高效的高级氧化技术。但在其实际应用中仍存在以下几个问题:(1)H2O2与O3的投加量难以确定。在一定范围内增加H2O2可以促进·OH的产生,但过量的H2O2会猝灭·OH,影响有机物的去除率。(2)H2O2/O3体系受溶液pH的影响较大。在中性及碱性条件下,溶液中会有大量的无机碳(如HCO3-、CO32-)存在,导致·OH的猝灭;在酸性条件下,H2O2很难发生去质子化反应,从而影响·OH的产生。
2.4 金属催化臭氧氧化技术
金属催化臭氧化技术即通过在臭氧化过程中加入一些金属氧化物或金属离子促进臭氧分解产生·OH。按照催化剂的形态,可以将催化臭氧化分为:均相催化臭氧化(催化剂以金属离子形态存在)以及非均相催化臭氧化(催化剂为金属氧化物固体或将金属/金属氧化物负载在固相载体上)。
2.4.1 均相催化臭氧化
研究表明在臭氧化过程中加入过渡金属离子(如Mn2+、Fe3+、Fe2+、Cu2+、Ni2+等)可以促进臭氧分解。葛玮等在单独臭氧化体系中分别加入Fe3+、Fe2+、Ni2+为催化剂,形成均相金属离子催化臭氧化体系降解活性艳蓝X-BR。结果表明加入这些金属离子后可以不同程度地提高活性染料去除率,且在初始溶液pH=12时具有最佳催化效果。Andreozzi等在酸性条件下研究了Mn2+对催化臭氧化降解草酸的作用机制。结果表明单独臭氧化对草酸几乎没有去除效果,加入Mn2+催化剂可以显著提高草酸的去除率。在pH为0时,草酸的降解符合一级反应动力学,其反应速率常数为6.2×104L·mol-1·s-1。在pH为4.7时,通过研究草酸的氧化历程提出了一种自由基臭氧化机理。
通过对均相金属催化臭氧化体系的不断研究,发现其催化机理主要可以分为两类。第一类是过渡金属离子促进臭氧分解产生·OH。Wilde等以医院废水中难降解的β-受体阻滞剂为目标有机物,对比了单独臭氧化和Fe2+催化臭氧化对有机物及芳香类化合物的去除效果。研究发现Fe2+/臭氧化体系可以使有机物及芳香类化合物的去除率分别增加19%和29%,其机理如下式所示。
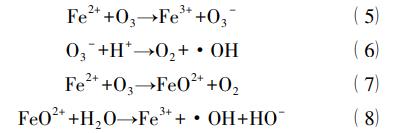
均相金属催化臭氧化体系的另一种催化机理则认为过渡金属先与有机物络合形成中间物质,然后被臭氧氧化去除。同时,过渡金属从络合物上脱落下来继续与有机物结合。Pines等以单独臭氧难降解的草酸为模拟废水,发现在酸性条件下加入Co2+可以显著提高臭氧的利用率,增加草酸的去除效果。通过对其中间产物及机理的探究,认为Co2+先与草酸络合形成CoC2O4,然后再继续与臭氧反应得到降解,如下述方程式所示:
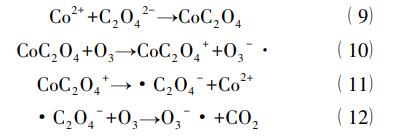
均相催化臭氧化虽然操作简便,催化效率高,但也存在明显的不足之处。整个过程催化剂是以离子的形态存在于体系中,存在催化剂流失,难以回收利用的问题,同时会对水体造成二次污染。
2.4.2 非均相催化臭氧化
常见的非均相金属催化剂主要有以下几种:(1)金属氧化物(如Al2O3、FeOOH、MnO2等);(2)负载型的金属或金属氧化物催化剂(如Co、CaO、Cu等负载在Al2O3、活性炭、蜂窝陶瓷等固相载体上)。
均相催化臭氧化虽然操作简便,催化效率高,但也存在明显的不足之处。整个过程催化剂是以离子的形态存在于体系中,存在催化剂流失,难以回收利用的问题,同时会对水体造成二次污染。
Wang等分别研究了在FeOOH和CeO2存在条件下,臭氧的分解速度及催化臭氧化去除甲基叔丁基醚(MTBE)的效率。结果表明,FeOOH和CeO2均可以不同程度地促进臭氧分解,增加目标有机物的去除率。Tong等以磺基水杨酸(SSal)和丙酸(PPA)为目标有机物,研究了不同类型的MnO2对催化臭氧化的降解效能。实验结果表明,MnO2的催化活性主要取决于目标有机物及溶液体系的pH值,与MnO2催化剂的类型没有直接关系。Liu等采用浸渍-热分解法成功制备了Ce-活性炭(Ce-AC)催化剂。在降解水中难生化物质芘和荧蒽的过程中发现,加入Ce-AC可以促进臭氧对有机物的降解。在考察催化剂稳定性实验中发现,用Ce-AC催化剂连续循环5次降解目标有机物时催化剂仍具有良好的催化活性。同时在检测处理后的水样中未发现Ce元素的浸出,说明Ce-AC催化剂具有良好的稳定性。
对于非均相催化臭氧化体系的催化反应机理,主要有以下两种解释:第一种认为过渡金属催化剂在反应中仅起到吸附有机物的作用,在催化剂表面形成螯合物。这些具有强负电荷的表面螯合物与臭氧(或羟基自由基)作用产生氧化副产物。最终经过解吸,在溶液中被臭氧或羟基自由基氧化降解;第二种则认为过渡金属催化剂首先与臭氧作用形成氧化态金属,并迅速吸附有机物,然后通过电子转移反应产生羟基自由基,从而有效降解有机物。除了以上两种推测之外,目前还有另一种说法认为催化剂在反应中仅起到催化分解溶解臭氧的作用,从而促进高活性氧自由基(·OH、·O2-、1O2)的产生。
Zhang等利用高比表面积、可折叠的石墨毡(GF)为载体,采用等体积浸渍法制备了MgO/GF催化剂。在中性条件下降解双酚A(BPA)的过程中发现,与单独臭氧化过程相比,加入MgO/GF催化剂可以使BPA和COD的去除率分别增加40.0%和31.6%。通过加入羟基自由基猝灭剂———叔丁醇,间接证明了MgO/GF/O3体系主要遵循羟基自由基的反应机理。同时对反应过程中溶解臭氧浓度进行检测,发现加入催化剂后溶液中的臭氧浓度始终处于较低水平。因此,作者认为MgO/GF可以提高臭氧化效率的原因主要是催化剂表面的碱性位可以促进臭氧分解产生·OH,如下述方程式所述。
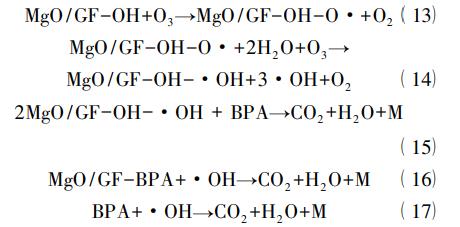
式中:MgO/GF-OH表示催化剂表面的碱性位,M代表中间体。
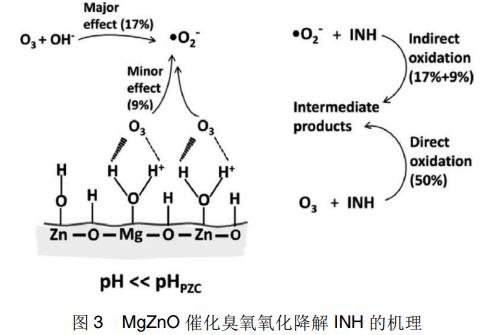
Shen等采用热分解法制备了一种Mg掺杂ZnO的催化剂(MgZnO)。在中性条件下以异烟肼(INH)为模拟废水,研究了不同臭氧化过程中INH的去除率。结果表明,加入MgZnO催化剂之后可以显著提高臭氧化降解INH的效率。作者分析了不同条件下溶液中溶解臭氧浓度,发现相同条件下加入MgZnO催化剂后,溶液中的溶液臭氧浓度均会有不同程度的下降。因此推测该催化剂表面存在某些表面活性位点可以诱导臭氧分解为活性氧自由基。通过自由基探针实验,发现MgZnO/O3体系中的主要活性物质并不是羟基自由基(·OH),而是超氧自由基(·O2-),并提出了其反应机理。首先水分子被吸附MgZnO表面,然后分解成OH-和H+。MgZnO上的路易斯酸性位(Mg2+和Zn2+)和布朗斯特碱性位(O2-)分别与OH-和H+相互作用。由于溶液的初始pH值为7.2远低于MgZnO的pHpzc(零电荷点),MgZnO催化剂表面羟基被质子化,溶液中的H+浓度降低,pH值上升。溶液中的溶解臭氧通过静电力和氢键与催化剂表面大量的质子化羟基相互作用分解,形成超氧自由基,如图3所示。
Wang等采用改进的Hummers'方法成功制备了不含金属元素的还原氧化石墨烯催化剂(rGO)。在降解对羟基苯甲酸(PHBA)的过程中发现rGO材料在活化臭氧过程中具有良好的催化活性。与单独臭氧化过程相比,加入rGO催化剂后在30min内即可完全去除PHBA,并将TOC去除率从原来的25%提升至95%。通过电子自旋共振(ESR)法和自由基探针实验两种方法,均证明了超氧自由基(·O2-)和单线态氧(1O2)是促进PHBA降解的活性物质,而羟基自由基(·OH)在这个过程中并没有起到明显的促进作用。此外,作者还发现rGO催化剂表面的羰基是可以促进臭氧分解的活性位点。该反应机理如下图4所示,rGO催化剂表面存在大量的含氧官能团,如羟基、羧基、环氧基等。其中,富电子的羰基与臭氧结合之后可以促进臭氧分解为高活性的超氧自由基(·O2-)和单线态氧(1O2),有效降解PHBA。
在降解对羟基苯甲酸(PHBA)的过程中发现rGO材料在活化臭氧过程中具有良好的催化活性。与单独臭氧化过程相比,加入rGO催化剂后在30min内即可完全去除PHBA,并将TOC去除率从原来的25%提升至95%。通过电子自旋共振(ESR)法和自由基探针实验两种方法,均证明了超氧自由基(·O2-)和单线态氧(1O2)是促进PHBA降解的活性物质,而羟基自由基(·OH)在这个过程中并没有起到明显的促进作用。此外,作者还发现rGO催化剂表面的羰基是可以促进臭氧分解的活性位点。该反应机理如下图4所示,rGO催化剂表面存在大量的含氧官能团,如羟基、羧基、环氧基等。其中,富电子的羰基与臭氧结合之后可以促进臭氧分解为高活性的超氧自由基(·O2-)和单线态氧(1O2),有效降解PHBA。
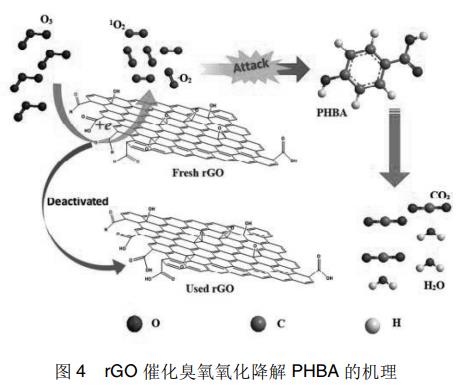
Ghazi等在研究催化臭氧化过程中的活性物质时,与Wang等有相似的结果。作者以MnO2为催化剂,在降解苯酚溶液的过程中发现,O3分子的直接氧化以及超氧自由基(·O2-)和单线态氧(1O2)的间接氧化是促进有机物降解的主要原因,而羟基自由基(·OH)在该过程中并没有起到直接的作用。同时作者通过苯酚上不同种类的取代基,研究了不同自由基种类在该降解过程中的贡献度。结果表明,当苯酚上连有吸电子基团(-Cl)时,超氧自由基(·O2-)在降解过程中起主导作用,属于亲核反应。当苯酚上连有供电子基团(-CH3)时,单线态氧(1O2)是促进有机物降解的主要原因,属于亲电反应。
非均相催化臭氧化技术不仅具有高效简便的特点,且在一定程度上解决了催化剂循环利用的问题,是近几年研究的热点方向。但在实际应用过程中,依然存在以下几个问题:需要研究实际废水中可能存在的物质,并考虑其对降解反应过程的影响;需要从实际应用出发,考察催化剂的寿命及反应器设计等问题;需要考察实际应用过程中各个工艺参数对反应的影响。
3、结论
臭氧自被人类发现以来,已被广泛运用于水处理消毒等方面。单独臭氧往往不能使有机物彻底降解,需要将臭氧与其他技术联合使用。比较常见的有以下几种:紫外/臭氧氧化(UV/O3)、过氧化氢/臭氧氧化(H2O2/O3)、金属催化臭氧氧化。其中,金属催化臭氧氧化中的非均相催化臭氧化技术因为具有高效简便的特点,且在一定程度上解决了催化剂循环利用的问题,是今后臭氧高级氧化技术研究的重要方向。(来源:浙江闰土股份有限公司)
