近年来,随着生态文明的建设不断推进以及环保法规的不断完善,能源化工行业对水处理技术的需求日趋迫切。煤化工废水往往呈现水质成分复杂、高盐高COD的特点,总溶解性固体(TDS)普遍达10000~100000mg/L,COD普遍达100~5000mg/L。废水中的有机物成分复杂,其中卤代烃、多环芳烃和杂环化合物等不仅会对环境具有严重危害,而且在处理过程中还会造成膜污染、结晶纯度下降等现象,因此在膜浓缩和蒸发结晶单元前须将这些有机物去除。
高级氧化技术(AOPs)是在光、电、催化剂等条件下生成强氧化性的羟基自由基(OH·),将大分子有机物逐渐分解为的小分子物质,有效降低废水COD含量,具有反应速率快、应用范围广的特点。根据反应条件不同,高级氧化技术主要分为芬顿氧化法、臭氧氧化法、电催化法、光催化法等。
芬顿氧化是利用过氧化氢(H2O2)在亚铁离子(Fe2+)的催化作用下生成OH·,从而实现对有机物的氧化分解。芬顿氧化的工艺简单,H2O2和Fe2+廉价易得,反应生成的Fe3+同时起到絮凝作用,常被用于处理制药废水、印染废水和垃圾渗滤液。Jia等人利用芬顿氧化处理COD含量为616mg/L的煤化工废水,COD去除率最高达到69.8%。Yu利用芬顿氧化处理COD含量为1515mg/L的电镀废水,COD去除率最高达到89.3%。然而,芬顿氧化在不同条件下的处理效果波动较大,需要对pH和加药量做精确的控制;其反应的同时会产生过多的污泥,造成二次污染。为了提高反应效率并降低成本,研究者们将光、电、微波、超声等能量引入芬顿体系中,使COD去除率得到大幅提升。此外,还可通过将Fe2+负载到固态催化剂上,避免污泥的产生。
电催化氧化是利用具有催化活性的电极材料进行电解反应,电解池阳极可将有机物直接氧化,同时还能生成OH·、ClO-等强氧化剂,释放到水中,进行间接氧化。电催化氧化的反应条件易于控制,无需添加药剂,不会产生二次污染。电催化阳极材料的选择至关重要,钛基金属氧化物电极相较于Pt等贵金属电极成本较低,同时具有良好的催化性能和稳定性,还可以通过掺杂离子或纳米颗粒进一步改性。此外,研究者们还通过颗粒或碎屑投入水质构成三维电极,增加反应面积的同时缩短电极间距,显著提升反应效率。
本研究课题以某煤化工企业产生的三段高盐高COD废水为处理对象,探究芬顿氧化和电催化氧化的最优条件,对两种技术的处理效果和经济性进行对比,为高级氧化工艺在高盐高COD废水中的应用提供可靠参考。
1、实验
1.1 水样水质分析
某煤化工企业采用纳滤-反渗透-结晶工艺处理生化池出水,从而实现废水的回用和盐的资源化利用。废水中的COD是结晶过程中重要的影响因素之一,当COD浓度过高时会影响水的粘度、盐溶解度和结晶盐纯度。为了使结晶盐品质达到工业盐标准,需在蒸发结晶前去除废水中大部分COD。
如表1所示,实验原水来自煤化工废水处理工艺中的三个取样点,随着浓缩倍率增加,COD含量逐级上升。

1.2 药品和仪器
实验药品:FeSO4·7H2O、30%H2O2溶液、浓H2SO4、NaOH。
实验仪器:六连同步电动搅拌器、30V直流电源、钛+钌铱阳极电极10cm×10cm、316L不锈钢阴极电极10cm×10cm、10cm×10cm×5cm电解槽、COD分析仪。
1.3 实验方法
(1)芬顿氧化法:取500mL水样于烧杯中,滴加浓硫酸调节pH(误差不超过0.05),搅拌桨开始搅拌,加入一定量的硫酸亚铁(固状),待完全溶解后加入双氧水,反应一段时间后停止搅拌,滴加氢氧化钠溶液调节至pH大于7,搅拌5min使铁离子完全沉淀,静置2h(或离心1min),取上清液测COD。
(2)电催化法:取500mL水样于电解槽中,插入电极(电极间距5cm)后通电,控制电源为恒流模式,调节电流恒定,每15min取上清液测COD。
2、结果与讨论
2.1 芬顿氧化处理高盐高COD废水影响因素
2.1.1 H2O2和Fe2+加量与摩尔比
在芬顿氧化过程中,H2O2和Fe2+的加药量和摩尔比是影响COD去除率的主要因素。理论上1gCOD完全被氧化需要1gO2,而1molH2O2可生成0.5molO2,据此可计算出H2O2所需用量的理论值。而在实际反应中Fe2+和自身分解会额外消耗H2O2,因此H2O2的实际用量远大于理论值。Fe2+在溶液中起到催化H2O2生成OH·从而分解有机物的关键作用,但当Fe2+浓度过高时,会导致大量铁泥的产生,加重二次污染。为探究H2O2投加量的影响,取3号水样500mL(COD=916mg/L)为原水,滴加硫酸调节至pH=4,固定n(H2O2):n(Fe2+)=15,分别投加1、2、3、4、5和6mL30%H2O2(对应投加0.164g、0.328g、0.492g、0.656g、0.820g和0.984gFeSO4·7H2O)。反应过程中,会迅速生成大量泡沫和棕红色沉淀,这是由于部分Fe2+被氧化为Fe3+,并水解沉淀。如图1所示,COD去除率随H2O2投加量增加而上升,当H2O2投加量达到4mL时,COD去除率达到31.0%,计算得到去除1gCOD需投加8.45gH2O2。为探究n(H2O2)∶n(Fe2+)的影响,固定FeSO4·7H2O投加量为0.492mg,分别投加1、2、3、4、5和6mL30%H2O2(对应n(H2O2)∶n(Fe2+)为5、10、15、20、25和30)。如图2所示,COD去除率随n(H2O2)∶n(Fe2+)的增加先上升后下降,当n(H2O2)∶n(Fe2+)=15时达到最大值42.8%。
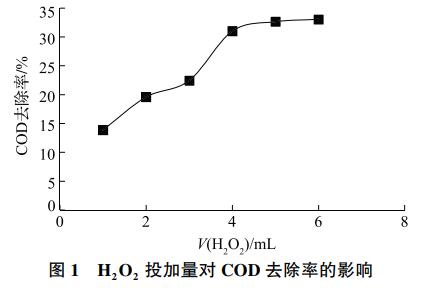
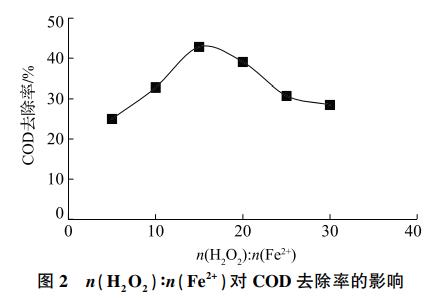
2.1.2 pH
pH是芬顿氧化的另一关键因素。当pH大于2时,Fe2+开始沉淀为Fe(OH)2,对生成OH·具有更高的催化活性。但pH过高会使Fe3+开始沉淀,芬顿反应终止,逐渐消耗Fe2+。为探究pH的影响,将6组水样的pH分别调至2、3、4、5、6和7,投加0.492gFeSO4·7H2O和4mLH2O2(n(H2O2)∶n(Fe2+)=15)。如图3所示,COD去除率随pH的升高先上升后下降,当pH=5时达到最大值21.4%。
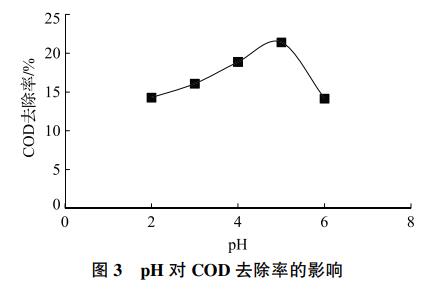
2.1.3 反应时间
为探究反应时间的影响,将水样调至pH=5,投加0.492gFeSO4·7H2O和4mLH2O2(n(H2O2)∶n(Fe2+)=15),每0.5h测一次COD。如图4所示,反应0.5h后COD去除率达到25.8%,反应1h后达到27.3%,之后不再发生明显变化。结果表明在最初的0.5h中,芬顿氧化反应快速进行,并在1h内完全反应。

为探究最佳反应条件,设计了L9(34)正交实验,实验条件如表2所示,实验结果如表3所示。通过极差大小的比较,各因素对COD去除率的影响大小依次为pH>n(H2O2)∶n(Fe2+)>H2O2加药量。综合考虑芬顿氧化的最优条件:n(H2O2)∶n(Fe2+)为5~15,H2O2加药量为3~5mL,pH为4~5。此外,还测定了反应前后水样的Fe含量和浊度,结果如表4所示,反应后Fe含量和浊度均有所下降,表明Fe2+和Fe3+完全沉淀,且澄清效果好。

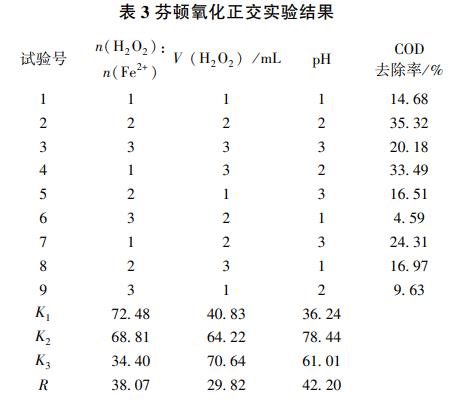

2.2 电催化氧化处理高盐高COD废水
2.2.1 电流密度
电催化的电流密度是影响COD去除率的关键因素。电流密度过小反应速率慢,电流密度过大则会增大处理成本。为探究不同电流密度下的电催化氧化效果,取3号水样分别在电流密度为10mA/cm2、20mA/cm2、30mA/cm2、40mA/cm2和50mA/cm2的条件下进行实验。实验过程中,液体生成大量泡沫,并有刺激性气体逸出,这是由于部分氯离子在阳极被氧化为氯气(Cl2)。实验结果如图5所示,COD去除率与电流密度的大小呈显著正相关。在电流密度为10~20mA/cm2的条件下,COD去除率随时间缓慢上升,反应60min仍呈上升趋势。在电流密度为30~40mA/cm2的条件下,反应45min后COD去除率上升速度明显减缓。在电流密度为50mA/cm2的条件下,反应45min后COD去除率达到99.9%。
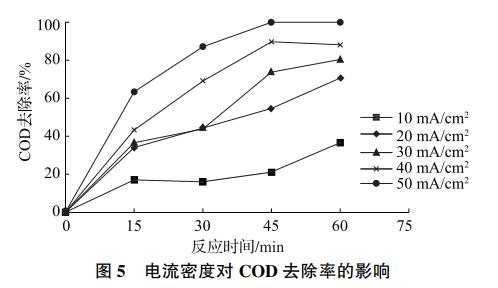
2.2.2 pH
水样的pH影响Cl-在反应过程中的形态,从而影响间接氧化的反应效率。为探究pH对反应的影响,取3号水样分别将pH调至4、5、6、7和8,在电流密度为30mA/cm2的条件下进行实验。实验结果如图6所示,COD去除率随着pH的降低先上升后下降,在pH=5时达到最大值。这是由于Cl-在阳极被氧化生成ClO-,而ClO-在酸性条件下氧化性更强。但当pH过低时,ClO-将转化为氯气从水中逸出,从而降低反应效率。
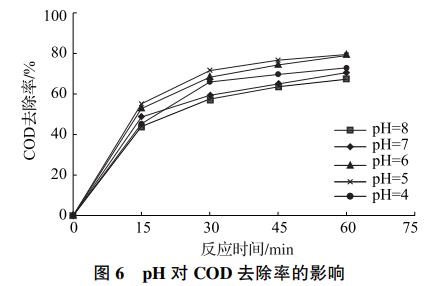
2.2.3 水样和催化剂
为探究不同水样的电催化氧化效果,分别取1、2和3号水样在30mA/cm2的电流密度下反应60min。实验结果如图7所示,1号水样的COD去除率在30min内达到99.9%,这是由于该水样COD较低,在较短时间内即可完全反应。2号水样的COD比3号水样较低,且Cl-浓度较高,因此COD去除率略高于3号水样。此外,还将用于臭氧催化氧化的两种颗粒状催化剂投入反应槽中,由于该催化剂均为绝缘体,加入反应池后使电极间的电阻增大,在反应过程中大量放热,水体温度显著升高,短时间内能够加快反应速率,但对反应无明显催化作用,且增加大量能耗。此外,经过一系列的实验(总计约20h)后,3号水样在电流密度为30mA/cm2条件下的COD去除率由80.4%降至67.8%,电极老化现象显著。

3、两种高级氧化技术的对比
如表5所示,通过两种高级氧化技术的对比可以看出,芬顿氧化工艺中废水需要经过调节、反应、中和、沉淀等步骤,并依次投加多种药剂,反应条件不易控制,COD去除率有限,酸性条件下对设备腐蚀较为严重,且生成大量铁泥难以利用,作为危废处理需额外增加成本。电催化氧化工艺仅反应一项步骤,除调节pH所需少量硫酸外无需投加药剂,COD去除率可根据出水要求灵活控制,生成氯气可用于配置消毒剂实现资源化利用。在处理成本方面,芬顿氧化的处理成本显著低于电催化氧化,且工艺成熟,已实现大规模工业应用。而电催化氧化电耗成本较高,且阳极电极易腐蚀老化,尚无大规模工业应用。

4、结论与讨论
(1)芬顿氧化的最优n(H2O2)∶n(Fe2+)为5~15,每0.5L废水的H2O2加药量为3~5mL,pH为4~5,COD去除率最高达到42.8%。
(2)电催化氧化的最优pH为5~6,COD去除率与电流密度的大小呈显著正相关,最高可达99.9%。
(3)与芬顿氧化相比,电催化氧化具有工艺流程短,消耗药剂少,COD去除率可调控等优点,但电耗成本高,尚无成熟应用。
(4)针对COD含量高、成分复杂的高盐废水,单一的高级氧化技术很难高效降解有机物。芬顿氧化的技术成熟度高,处理成本低,但H2O2的利用率低,COD去除率有限,且生成铁泥难以利用,仍有很大的发展空间。光-芬顿、电-芬顿等耦合技术以及非均相复合催化剂的研发成为芬顿氧化的发展方向。电催化氧化的操作简单、COD去除率高且无二次污染,但高昂的处理成本使其难以大规模应用,延长电极寿命、提高电流效率成为电催化电极的研究方向。(来源:内蒙古国华呼伦贝尔发电有限公司,北京低碳清洁能源研究院)
