目前, 我国的一些地区水质环境差、水环境隐患多、生态受损重等问题较为突出, 群众健康受到严重损害, 影响经济社会的可持续发展.为了切实加大水污染的防治力度, 确保国家水质安全, 截至到2020年, 全国严重污染水体要有大幅度减少, 水环境质量要得到阶段性改善.京津冀区域人均占有水资源量只有全国平均水平的10%, 属于水资源短缺十分严重的地区.另外, 该地区长期处于“有河皆干, 有水皆污”的局面.七大流域的国控断面Ⅳ、Ⅴ类和劣Ⅴ类地表水比例依然达到了35.8%.
我国北方地区雨量较小, 地表水体生态基流较为匮乏, 除了短暂的雨季, 大部分水源来自城市污水处理厂尾水.尾水的水量比较稳定, 但现有污染物浓度限值远高于地表水Ⅳ类标准, 水中含有的有机无机氮磷, 排入河道后由于温度高水流缓慢, 会引起地表水体富营养化及黑臭现象等.TN是限定污水处理厂尾水回用的主要因素, 而氮在尾水中主要以无机氮(NH4+-N和NO3-N)的形式存在.因此, 如何去除城市污水处理厂尾水中的NH4+-N、NO3--N, 是尾水强化净化的关键步骤.
生物治理技术具有操作简单、运行费用低、不产生二次污染且效果显著等优点, 目前已成为氮污染治理与控制的重要方法.其中的生物膜修复技术是使微生物附着生长在纤维膜表面, 形成生物膜, 当污水流经生物膜表面时, 污染物被膜上的微生物吸收转化, 从而使污水得以净化.该技术将天然过程与人工过程完美结合, 已成为污染水体治理领域的研究热点.但目前多数研究只局限于对浮床植物的筛选以及构建预负载高效污染物降解与转化微生物的生态浮床, 强化微生物对水体中污染物的降解能力, 另一方面主要集中在利用微生物和水生植物的协同作用达到净化污水的目的, 却忽视了微生物在河道不同深度所处的微环境不同, 以致于影响生物膜对水体的降解效果.其次, 水体流速较大会损害生态浮床整体的稳定性, 同时, 生态浮床的大面积覆盖将会造成溶解氧含量的下降, 影响微生物的生长繁殖, 从而影响生态浮床的净化效果.
因此, 试验以模拟的城市污水处理厂一级B出水为研究对象, 选用性质稳定且透气性较好的聚丙烯纤维膜作为微生物载体, 将生物浮床安装在模拟河道中, 试图增加生物膜在河道中的长度、延长微生物的作用时间、提高水体中生物膜覆盖面积, 考察生物膜长度、HRT及生物膜覆盖面积对生物膜生态浮床处理含氮尾水的影响, 实现水体中微生物生态系统的原位调控, 强化水体自净能力, 以期为地表富营养化水体的治理提供理论依据.
1 材料与方法1.1 试验用水
按照污水处理厂一级B出水标准配制模拟污水厂尾水, 初始水质指标测定结果见表 1.试验过程全部采用HJ标准测定NH4+-N、NO3--N和TN等水质指标.
表 1 尾水初始水质指标/mg ·L-1

1.2 水样测定方法
氨氮浓度测定采用纳氏试剂分光光度法, 所用仪器装置为上海棱光技术有限公司出产的22PC06119型可见分光光度计.硝酸盐氮浓度的测定所用紫外分光光度计是上海UNICO电子公司出产的UV-2802, 主要包括由光源、单色器、吸收池、检测器和信号处理器等部件组成, 测定方法及注意事项见标准.总氮浓度测定采用紫外分光光度法, 所用仪器装置为UV-2802型紫外分光光度计.试验过程中主要用鼓风干燥箱(101型)对玻璃器皿进行干燥以及FA2104N型分析天平对药品进行称量.用葡萄糖(C6H12O6, AR)、磷酸氢二钾(KH2PO4, AR)以及硫酸铵[(NH4)2SO4, AR]配制试验用水.
1.3 浓度计算
测定水样中氨氮的吸光度, 用超纯水代替水样作为空白, 空白溶液和其他铵标准使用溶液按与样品相同的步骤测定吸光度.水中氨氮的浓度按式(1)计算:
式中, ρN表示水样中氨氮的质量浓度(以N计), mg ·L-1;As表示水样的吸光度;Ab表示空白试验的吸光度;a表示校准曲线的截距;b表示校准曲线的斜率;V表示试料体积(mL).
测定水样中硝酸盐氮、总氮的吸光度, 空白溶液和其他硝酸钾标准使用溶液制得的校准系列完成全部分析步骤, 测定方法见标准, 用紫外分光光度计于波长220 nm和275 nm处测定吸光度后, 分别按下式求出除空白外其他校准系列的校正吸光度As和空白的校正吸光度Ab及其校正吸光度Ar.
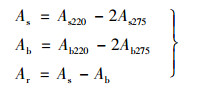
式中, As220表示标准溶液在220 nm波长的吸光度;As275表示标准溶液在275 nm波长的吸光度;Ab220表示空白溶液在220 nm波长的吸光度;Ab275表示空白溶液在275 nm波长的吸光度.
总氮计算:按式(2)中计算标准溶液的Ar值与相应地总氮含量(μg)绘制标准曲线, 再根据水样Ar值, 在校准曲线上查出相应地总氮含量(μg), 总氮质量浓度cN(mg ·L-1)按下式计算:
式中, Ar表示试样校正吸光度;V表示试样体积mL;a表示校准曲线的截距;b表示校准曲线的斜率.
硝酸盐氮计算:按式(2)中计算硝酸盐氮标准溶液的Ar值与相应的硝酸盐氮质量浓度(mg ·L-1)绘制标准曲线, 根据求得的水样吸光度Ar值, 从校准曲线中查得相应的硝态氮质量浓度.
1.4 试验装置构建
1.4.1 模拟河道反应器
本试验所用装置为模拟的河道反应器, 设定反应器长、宽和高分别为18、0.5和0.5m, 坡度为10‰.模拟河道反应器由有机玻璃制成, 设有进水区、反应区和出水区, 进水区与反应区之间用挡水板隔开.
具体设计见图 1与图 2.
图 1
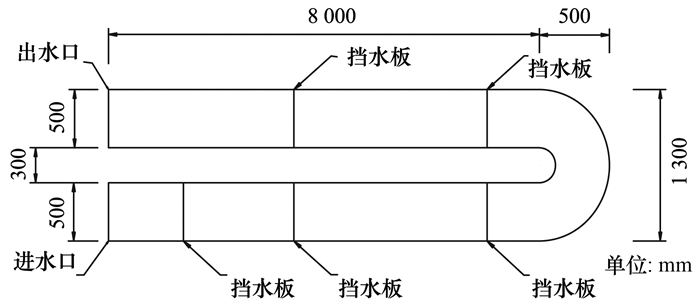
图 2

(1) 进水口处设置有高度为300 mm的挡板, 形成存水槽以保证河道内的水流稳定, 避免进水对河道内产生过大搅动.
(2) 每条河道配置一台蠕动泵, 以便设定不同的进水流量.河道每隔4 m设置一个高度不同的挡板, 使河道内水流动过程中产生跌水为河道内的水加氧, 模拟真实环境.
(3) 河道底端铺设底泥, 模拟真实河床同时便于生物膜的形成.出水口设置高度为300 mm的挡板, 河道内的水在挡板上方溢流而出, 形成稳定水面.
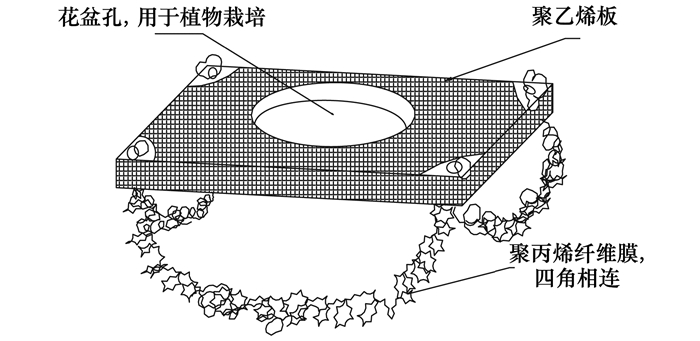
1.4.2 生物浮床
浮床床体为聚乙烯板, 其4个角各有一个圆孔用来连接已经喷上菌胶液的纤维膜(图 3).纤维膜采用聚丙烯材料, 它具有很强的散热性能, 对水的阻力较小, 布水、布气性能好, 有益于微生物的生长, 同时又具有切割气泡的作用.根据河道深度, 按照比例截取生物膜长度.中间为直径10 cm的小孔, 用于后期栽培植物, 美化河道环境.
图 3
1.5 运行工况
试验采用连续式进水方式, 由蠕动泵固定流速通入河道, 河道出水由相同流速的蠕动泵抽出, 以保证河道中水体的流动性和水量的一致性.试验采用3种工况, 各运行3个周期.工况1在河道反应器内通入污水处理厂尾水, 将生态浮床上悬挂不同长度生物膜(1/2水深、1倍水深)运行, 生态浮床覆盖面积为河道的10%, 温度为25℃, 时间为10 d;工况2模拟污水处理厂尾水, 在不同HRT(6 d和12 d)条件下运行, 控制生物浮床生物膜长度为1/2水深, 膜覆盖面积为10%, 温度为25℃;工况3模拟污水处理厂尾水, 在不同生物浮床覆盖面积(0%、10%和20%)条件下运行, 控制河道生物浮床挂膜长度为1/2水深, HRT为6 d, 温度为25℃, 运行2个周期.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
2 结果与讨论
2.1 悬挂式生物膜对含氮尾水的净化特征及影响分析
图 4表示工况1运行条件下空白河道与悬挂生物膜河道对含氮尾水中氮素的去除效果分析.
图 4

从图 4(b)可以看出, 空白河道的NH4+-N浓度有一定的上升趋势, 但变化不太明显.悬挂1/2水深生物膜的河道内NH4+-N在前3 d处于下降趋势, 浓度从0.098 mg ·L-1降低到0.009 mg ·L-1, 而在第5 d时NH4+-N值上升到了0.522 mg ·L-1之后又降低到0.062 mg ·L-1, 到第7 d后趋于稳定, 说明NH4+-N值在第5 d出现较大波动, 但整体变化不明显.而整体水深悬挂生物膜的河道在第3 d和第7 d NH4+-N浓度出现拐点, 浓度值分别为0.498 mg ·L-1和0.601 mg ·L-1, 河道内初始NH4+-N值为0.639 mg ·L-1, 在第9 d时已经上升到1.093 mg ·L-1, 整体来看浓度处于上升趋势.结果表明, 在空白河道内NH4+-N值有所上升主要是因为河道内微生物的自身代谢较微弱, 随着时间的增加, NH4+-N不断积累.在悬挂生物膜的河道, 水中氮素的转化在缺氧条件下主要进行的是氨化作用, 有学者研究表明:氨化作用对溶解氧要求很广泛, 厌氧或好氧条件下均可进行.而硝化及反硝化细菌主要是好氧自养型细菌, 由于河道下部溶解氧浓度较低并且悬浮类有机物及藻类较少, 从而影响NH4+-N的转化.Cooper等[27]的研究指出, DO含量下降, 氨氮转化的效率不超过15%.因此, 整体挂膜河道中的NH4+-N浓度出现上升趋势.
由图 4(a)和4(c)可以看出:悬挂1/2水深生物膜的河道内的NO3--N和TN都呈下降趋势, 且NO3--N值从1.77mg ·L-1降到0.61mg ·L-1, 降解率达到了62.7%, TN值从5.60mg ·L-1降到1.01mg ·L-1, 降解率达到了81.96%.空白河道和整体水深悬挂生物膜的河道则变化不太明显.说明在河道上部溶解氧要大于河道底部, 悬挂1/2水深生物膜的河道内硝化细菌有较优越的溶解氧环境, 繁殖较快, NO3--N的去除效果要明显大于其他两个河道.此前一些研究指出:系统中硝酸盐积累量的减少和增加主要由好氧段硝酸盐的生成量与好氧段同步硝化反硝化以及后续缺氧段反硝化脱氮量共同作用的结果.氧的可利用性会影响AOB的分布, DO浓度过高对硝化速率的影响不大, 但浓度过低则会造成硝化速率降低.生物膜悬挂到河道底部时, 河道底部溶解氧浓度较低从而抑制了生物膜上硝化作用, 在河道1/2水深处水环境中具有合适的溶解氧.因此, 河道内悬挂1/2水深的生物膜对河道内氮素的去除较明显.
2.2 生物浮床在不同HRT下对含氮尾水的净化特征分析
图 5表示工况2运行条件下空白河道与不同HRT河道对含氮尾水中氮素的去除效果分析.
图 5
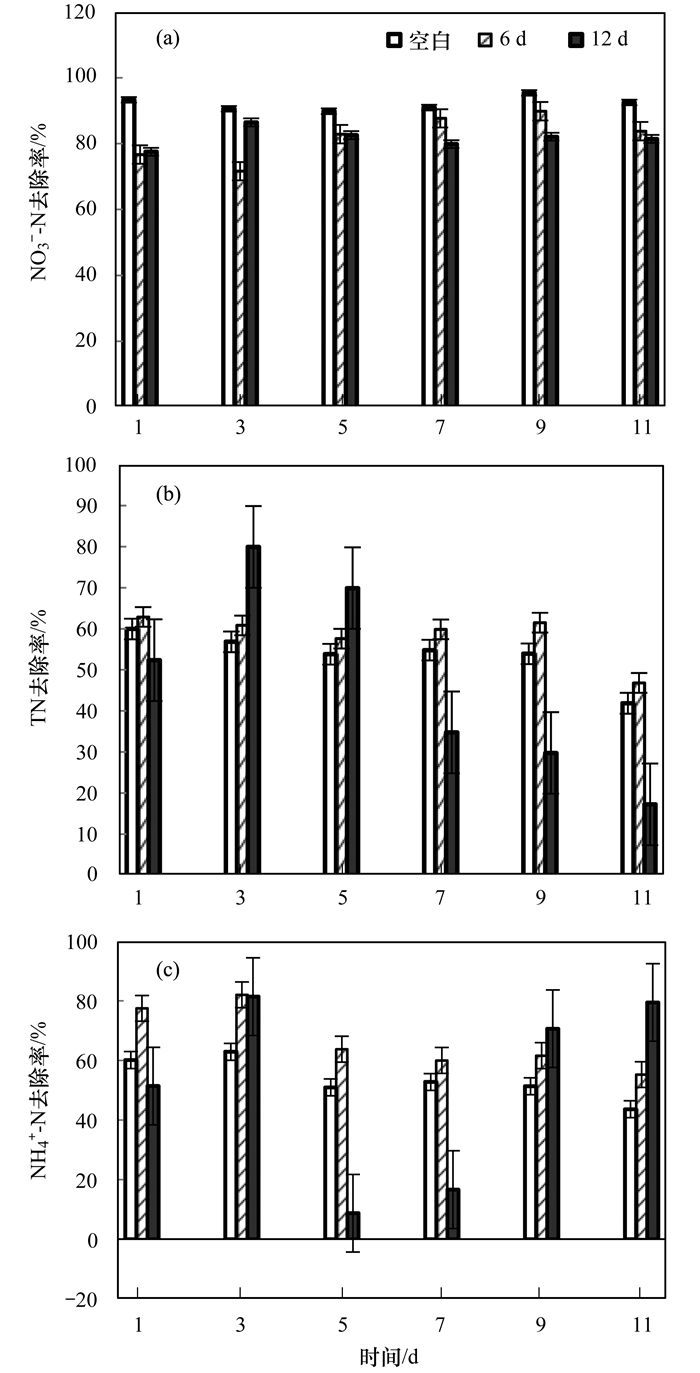
由图 5(a)可以看出, 在不同HRT条件下NO3--N去除率均维持在80% ~90%, 而空白河道的NO3--N去除率达到了90%以上, 这与苑泉等的研究HRT分别为12、8和4 h时, 对NO3--N去除率影响不大, 均能达到90%以上的结果相一致.说明在不同HRT条件下, 附着微生物生物浮床的同步硝化反硝化作用对于NO3--N的去除效率都较高, 且空白河道NO3--N的去除主要依靠河道内藻类和其他微生物代谢[30].从图 5(b)和5(c)可以看出, 在HRT为6 d时, TN的去除率总体维持在60%左右, NH4+-N去除率能达到70%左右, 而在HRT为12 d时, NH4+-N及TN的去除率波动性较大, TN的去除率最高可达79.93%, 最低到17.23%, NH4+-N的去除率最高可达81.4%, 最低到8.73%.有研究表明, HRT较长会使生物膜脱落, 填料上附着态微生物转化为悬浮态微生物.试验结果说明, 当HRT为6 d时, 生态浮床上的微生物可充分与水体接触且相对稳定, 能较好地发挥作用, 对于去除水中氮素的去除效果更明显.
2.3 生物浮床在不同覆盖面积下对含氮尾水的净化特征
图 6表示工况3运行条件下空白河道与不同生物膜覆盖面积河道对含氮尾水中氮素的去除效果分析.
图 6
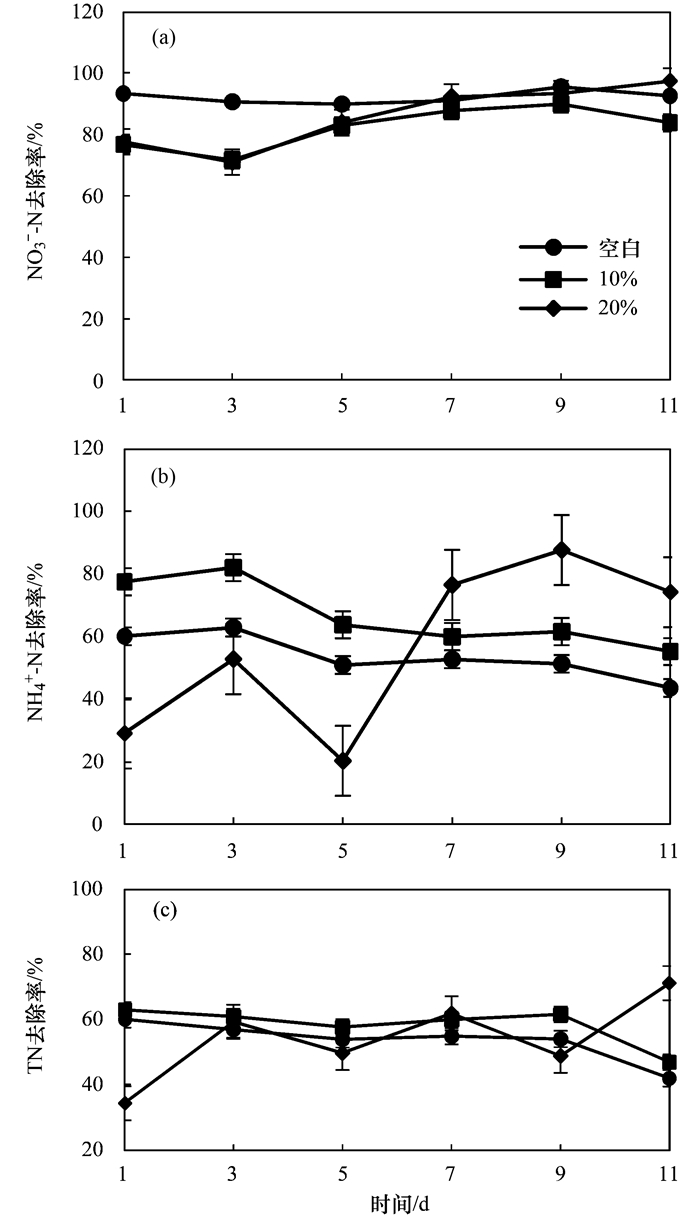
由图 6(b)可以看出:在生物浮床覆盖面积为10%时, 覆盖面积较小, 微生物数量少, 而水中NH4+-N的去除效率在逐步降低, 且和空白河道变化趋势相同, 说明当生物量较小时, 随着时间的增加, 水中的硝化细菌的转化效率减弱, 但在生物浮床覆盖面积为20%时, 在初期由于微生物浓度的急剧增加, 产生了一定的抑制作用, 使得NH4+-N去除效果有所下降, 但随着时间的增加, 水中NH4+-N的去除效率在不断增加, 去除率达到了87.62%.有学者研究表明, 成倍加入人工挂膜的浮床对于水中NH4+-N的去除有很明显的作用.因此, 生物浮床覆盖面积为河道的20%时对水中NH4+-N的去除效果较好.从图 6(c)可以看出, 在生物浮床覆盖面积为10%和20%时, TN最高去除率分别为62.88%和71.09%, 但在覆盖面积为10%时TN的去除率是呈下降趋势, 而覆盖面积为20%时TN的去除率是呈上升趋势的.而从图 6(a)结果中不难发现, NO3--N的去除效率都达到80%以上, 但覆盖生物浮床河道去除率是呈现上升趋势.结果表明, 由于生物浮床的覆盖面积增加, 作用于水体的氨化、硝化和同步硝化反硝化细菌的生物量相应地增加, 活性增强, 因此, 当生物浮床面积为20%时对含氮尾水中氮素的去除具有明显效果.
3 结论
(1) 在河道反应器内悬挂不同长度生物膜(1/2水深和1倍水深)运行条件下, 悬挂1/2水深生物膜的河道内硝化细菌有较优越的环境, NO3--N的去除效果要明显大于空白河道和整体水深挂膜河道, 对含氮尾水中氮素有较明显的去除效果.
(2) 在控制生物浮床生物膜长度为1/2水深, 膜覆盖面积为10%, 温度25℃, 不同HRT(6 d, 12 d)运行条件下, 不同HRT对NO3--N去除率影响不大, 当HRT为6 d时, 生态浮床上的微生物可充分与水体接触且相对稳定, 能较好地发挥作用, 对于去除水中氮素的去除效果更明显.
(3) 在控制河道生物浮床挂膜长度为1/2水深, HRT为6 d, 温度为25℃, 不同生物浮床覆盖面积(0%、10%和20%)运行条件下, 生物浮床覆盖面积为20%时, 对含氮尾水中氮素的去除具有明显效果.(来源:环境科学 作者: 赵志瑞)
