酸性矿山废水(acidminedrainage,AMD)具有污染时间长、成分复杂、处理成本高等特点,国内处理AMD的工艺已发展得较为成熟,其中石灰、石灰石中和法在工程应用中最为广泛。该类方法处理废水时会产生大量的沉渣,沉渣的成分主要为石膏和各类金属沉淀物。由于AMD的成分复杂,沉渣中的石膏晶体发育较差,沉渣中有价金属品位较低,利用难度较高。因此,设计出一种能从AMD中回收高品质的石膏以及高品位金属沉渣的工艺具有现实意义。
大宝山位于韶关市曲江区沙溪镇、翁源县铁龙镇境内,矿种以硫矿为主。含硫化物的废矿石在硫杆菌的作用下,发生氧化产生AMD。AMD呈强酸性,含有大量有毒(类)金属元素,污染危害严重。近年,相关单位已开展多起针对大宝山AMD的修复工程,矿区下游的生态环境已得到明显改善;但尾矿库坝内的废水中仍含有高浓度的金属离子,是潜在的重金属污染源。本研究使用的AMD均取自大宝山的尾矿废水,大宝山AMD中含有较高的SO42-、Fe2+/3+、Zn2+、Cu2+,采用石灰石中和法处理大宝山AMD时,回收的石膏不具备利用价值。原因是,废水中的各类金属离子会对中和石膏的结晶过程产生影响,导致其晶体发育较差,中和过程中废水中金属离子的沉淀也会导致石膏纯度降低。这类石膏杂质较多、游离水含量高抗压性弱,难以用于工业生产。
本研究以实现AMD的资源化处理为目标,采用氧化还原分步沉淀工艺,分别考察还原剂、回收石膏的工艺条件(石灰石投加次数、石灰石投加量、反应时间、搅拌速度)对回收石膏品质的影响;并采用正交实验优化回收石膏的工艺条件,对回收石膏的产量、纯度、成分进行分析;同时考察废水pH、曝气时间对废水中金属离子去除率的影响,确定分步回收金属的工艺条件,分析氧化还原-分步沉淀法处理AMD的经济效益,为AMD的资源化处理提供理论指导。
1、实验部分
1.1 实验材料
实验原水取自韶关市大宝山AMD,废水pH为1.9~2.4,废水中金属离子主要为Fe2+、Fe3+、Cu2+、Zn2+,废水中Fe2+/3+、Zn2+、Cu2+、Fe2+、Ni2+、SO42−的质量浓度分别为634~827、155~166、18~25、326~417、1.11~1.18、8527~9342mg·L−1。实验所用的石灰石为工业级,盐酸羟胺、硫酸、氢氧化钠均为分析纯。
1.2 实验步骤与工艺流程
取2组500mL实际废水,过滤除去悬浮物后,向其中一组加入一定量的盐酸羟胺,将废水中的Fe3+还原为Fe2+后;将一定量的石灰石分别加入2组废水中,反应45min后,过滤得到沉渣,将沉渣干燥后,保存待测。将废水中Fe3+还原后,将石灰石加入废水中,反应45min后过滤,测量废水中金属离子浓度,再将滤渣干燥后,保存待测。选取石灰石投加量为5~7g·L−1,转速为150~250r·min−1,投加3~5次、反应时间为30~60min,设计L9(43)正交实验,并测定生成石膏的产量、纯度、游离水含量。在曝气回收废水Fe2+/3+实验中,往滤液中加入NaOH溶液,调节废水pH至某一值后曝气,曝气量为4L·min−1,设置不同曝气时间,曝气后过滤,对沉渣进行分析,并测量废水中金属离子浓度。在NaOH溶液中和废水回收Zn2+、Cu2+实验中,向曝气后的滤液中加入NaOH溶液,继续调节废水pH至某一值,过滤后,将滤渣保存待测,并测量废水中金属离子浓度。氧化还原-分步沉淀工艺流程如图1所示。
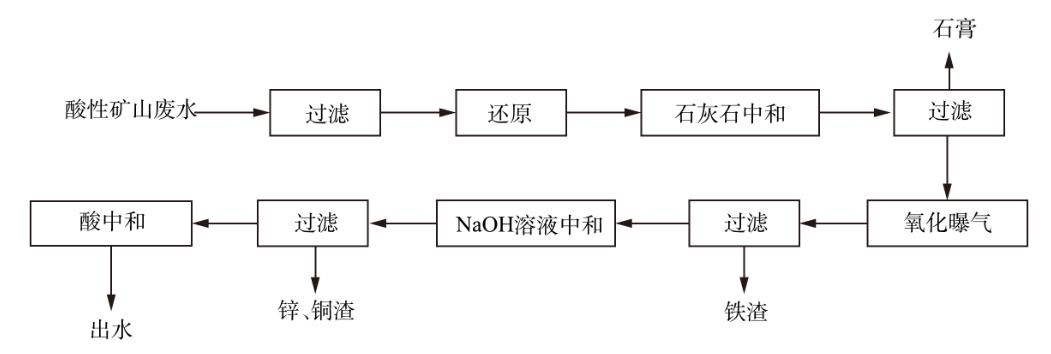
图1氧化还原-分步沉淀工艺流程
1.3 分析检测方法
石膏游离水、结合水、纯度均按标准《石膏化学分析方法》(GB/T5484-2000)的方法进行测定。废水中金属离子浓度用电感耦合等离子体质谱仪(美国PE公司NexION300D)进行测定。废水pH用PHS-3C型酸度计进行测定。采用X射线荧光光谱仪(XRF光谱仪)分析沉渣中金属组成及含量。采用HitachiS-480扫描电子显微镜(SEM)分析石膏的形貌。采用X射线衍射(XRD)仪分析石膏的物相。采用热重分析(TG-DSC)仪分析石膏的质量随温度的变化情况。
2、结果与讨论
2.1 还原剂对中和石膏的影响
2组石膏的XRD结果如图2所示。图2(a)为0.6g石灰石直接中和500mL废水回收的石膏;图2(b)为投加0.1g的盐酸羟胺将500mL废水中的Fe3+还原后,用0.6g石灰石中和废水回收的石膏。XRD结果表明,投加还原剂,将废水中的Fe3+还原为Fe2+后,并没有对沉渣中石膏晶体的矿物组成产生影响。沉渣中的水化产物主要为二水硫酸钙(PDF#33-0311),分别在2θ为11.617°、20.722°、23.380°、29.103°处出现了二水硫酸钙晶体的特征峰。
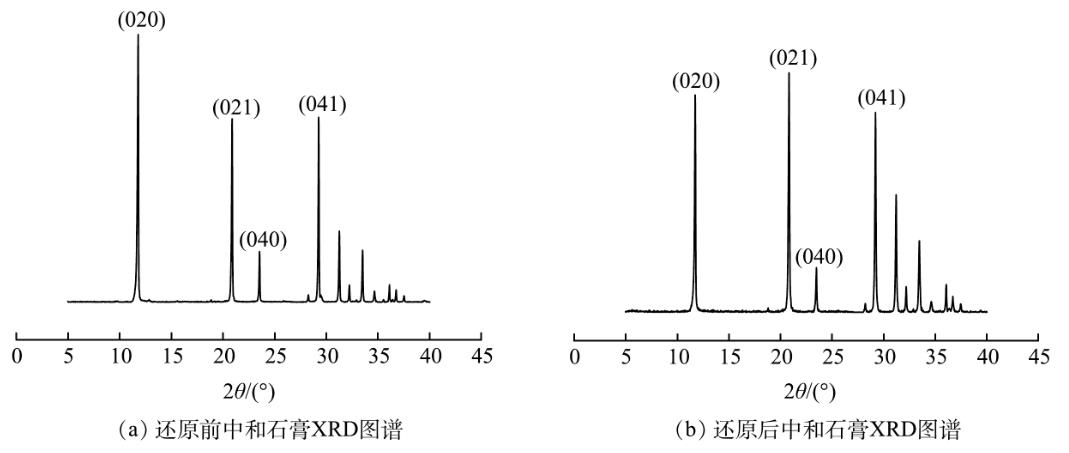
图2还原前、后中和石膏的XRD图谱
2组石膏的实物和形貌如图3所示。可以看出,图3(a)中的石膏为黄褐色,白度较低,当石膏含有杂质时,会呈现黄褐色、灰色等。SEM结果(图3(c))表明,石膏晶体呈颗粒状,粒径较小,晶体发育差。图3(b)中的石膏白度较高,颜色与天然石膏相近,所含杂质较少,SEM结果(图3(d))表明,晶体呈板柱状,与图3(a)石膏的晶体相比,粒径更大,晶体发育的更完整,这种石膏晶体抗压性更好,石膏游离水含量更低。

图3还原前、后中和石膏实物与SEM图谱
在石灰石中和废水的过程中,废水pH升高,废水中金属离子会形成氢氧化物沉淀,当废水中金属离子浓度低于10−5mol·L−1时,可视为该金属离子已完全沉淀。根据氢氧化物的溶度积可分别计算出各金属离子开始沉淀和完全沉淀的理论pH。Fe(OH)2、Fe(OH)3、Cu(OH)2、Zn(OH)2的溶度积分别为8×10−16、2.6×10−39、2.2×10−20、7.7×10−17,Fe3+开始沉淀的pH一般在2.11左右,完全沉淀的pH在3.5左右,而Fe2+、Cu2+、Zn2+开始沉淀的pH一般在6以上,完全沉淀的pH在9以上。废水经过还原处理后,提高了石膏的纯度,减少了废水中Fe2+/3+的沉淀,提高了后续废水处理中Fe2+/3+的回收率。
2.2 石灰石投加量对石膏、废水pH及金属离子去除率的影响
往AMD中投加0.2g·L−1盐酸羟胺进行还原处理后,控制转速为150r·min−1,反应时间为30min,石灰石投加量对石膏产量及废水中金属离子去除率的影响如图4所示。可以看出,石灰石投加量增加,废水pH升高,石膏产量和废水中金属离子的去除率增加。当石灰石投加量为2g·L−1时,废水pH为3.86,石膏产量为0.43g·L−1,此时废水中的金属离子几乎不发生沉淀。石灰石投加量为7g·L−1时,废水pH为5.64,石膏产量增加到6.36g·L−1,废水中Fe2+/3+、Zn2+、Cu2+的去除率分别为12.5%、5.1%、3.5%。当废水pH>5时,废水中金属离子的去除率陡增,故将石灰石的投加量控制在7g·L−1以下,废水的pH在5左右时,回收石膏的产量较高,并且废水中金属离子去除率较低。
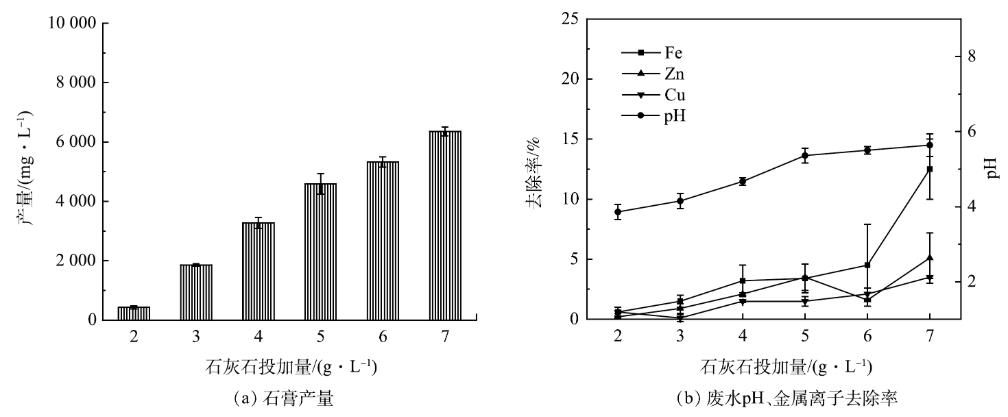
图4石灰石投加量对石膏产量、废水pH、金属离子去除率的影响
2.3 回收石膏工艺条件的优化
石灰石投加量为5~7g·L−1,转速为150~250r·min−1,投加3~5次、反应时间控制在30~60min时,可从AMD中回收品质较高的石膏。选取石灰石投加量、转速、石灰石投加次数、反应时间4个因素,每个因素均匀选取3个水平,设计L9(43)正交实验(表1)。对石膏的产量、纯度、游离水质量分数、形貌的结果进行综合分析,优化回收石膏的工艺条件。
为优化回收石膏的工艺条件,对9组正交实验生成石膏的产量、游离水质量分数、纯度进行分析,实验结果如图5所示。可以看出,编号1、2、3的实验中生成的石膏产量较低,为3.5~3.6g·L−1,编号4、5、6、7、8、9的产量较高,为5.4~6.8g·L−1,因此石灰石的投加量应控制在6g·L−1以上。
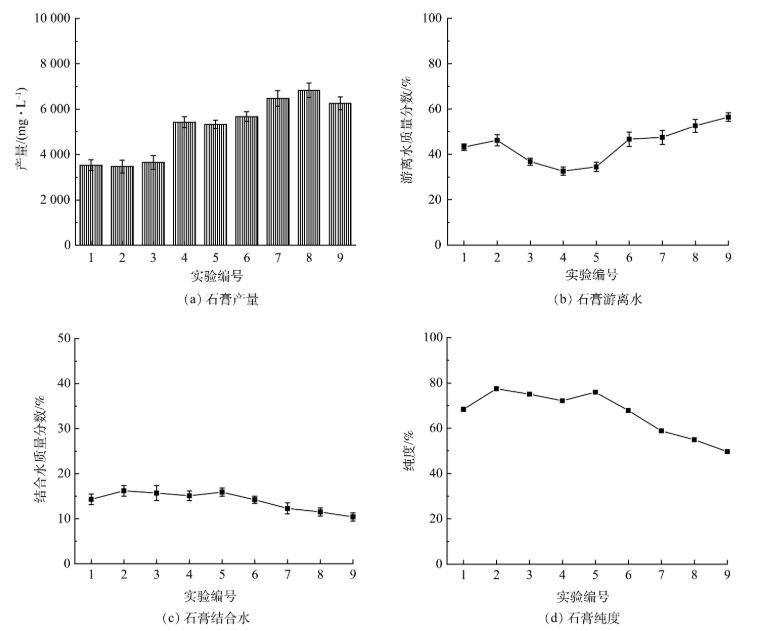
图5 9组实验中石膏的产量、游离水质量分数、结合水质量分数和纯度的实验结果
编号2、3、4的实验中生成的石膏游离水质量分数较低,分别为36.8%、32.6%、34.5%。由正交实验极差结果(游离水质量分数)可知,影响石膏游离水质量分数的因素依次是石灰石投加量、搅拌速度、石灰石投加次数、反应时间,回收的石膏游离水质量分数最低的工艺参数为A2B1C3D3,即石灰石投加量为6g·L−1、反应时间为30min、转速为250r·min−1、石灰石投加5次。
编号2、3、4、5的实验中生成的石膏结合水质量分数和纯度较高,石膏纯度为72.1%~77.4%。由正交实验极差结果(纯度)可知,影响石膏纯度的因素依次为石灰石投加量、搅拌速度、反应时间、石灰石投加次数,回收的石膏纯度最高的工艺参数为A1B2C3D2,即石灰石投加量为5g·L−1、反应时间为45min、转速为250r·min−1、石灰石投加4次。
综合考虑石膏的纯度、产量、游离水质量分数的影响,确定回收石膏的最佳工艺参数:石灰石投加量为6g·L−1、反应时间为45min、转速为250r·min−1、石灰石投加5次。该条件下回收石膏的游离水质量分数为44.6%、产量为5.4g·L−1、品位为76.3%。
优化工艺前后回收的石膏分析结果见图6。优化工艺前的反应条件:石灰石一次性加入废水中、石灰石投加量为6g·L−1、反应时间为45min、转速为250r·min−1;优化工艺后,先加入0.2g·L−1的盐酸羟胺对废水进行还原处理,将6g·L−1的石灰石间隔2min分5次加入废水中,并控制反应时间为45min、转速为250r·min−1。由图6(a)可以看出,优化工艺前回收的石膏晶体是由许多细小的颗粒堆积生长,晶体粒径较小,表面空隙较多,晶体发育较差。这种石膏游离水含量较高,利用难度较高。而改良工艺后回收的石膏(图6(b)),形貌呈光滑的板状,晶体发育完整,晶体粒径明显增大。这种石膏游离水含量较低,抗压性更强,具备更高的回收价值。

图6优化工艺前、后石膏的SEM图谱
优化工艺前后回收的石膏TG-DSC分析结果如图7所示。由图7(a)可以看出,温度为57.6~103.6℃时,DTG曲线较为平缓,石膏重量损失较慢,主要是石膏的游离水;温度为103.6~127.6℃时,DTG曲线中出现了一个较大的吸热谷,石膏重量损失较快,石膏的结晶水开始减少,石膏逐渐转化为半水石膏;温度为127.6~303.6℃时,DTG曲线较为平缓,石膏重量损失较慢,半水石膏脱水为无水石膏;303.6℃以后,石膏重量基本无变化,较为稳定。根据式(1)可计算石膏纯度。
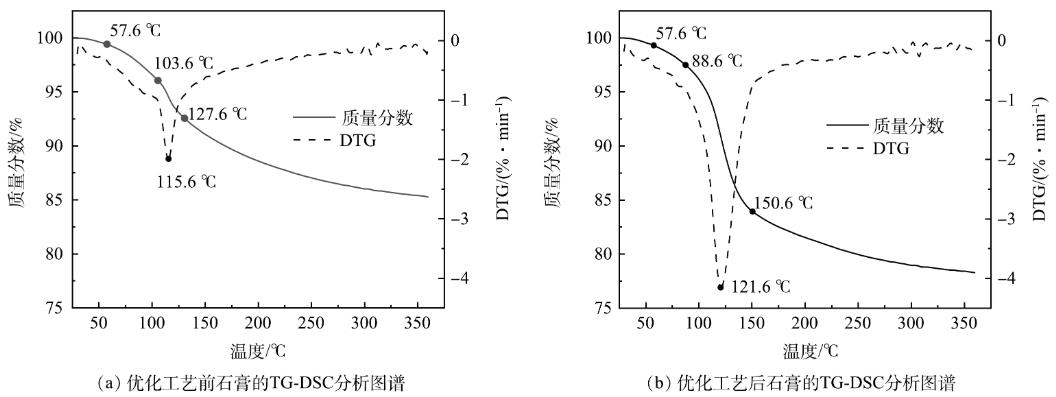
图7优化工艺前、后回收石膏的TG-DSC分析图谱
X1=4.7785c1
式中:X1为石膏纯度;c1为石膏结晶水质量分数。
可以看出,当石膏结晶水含量为10.27%左右时,由式(1)计算得出石膏的纯度为49.07%。
由图7(b)可以看出,温度为57.6~88.6℃时,DTG曲线较为平缓,石膏的游离水开始减少;温度为88.6~150.6℃时,DTG曲线中出现了一个较大的吸热谷,石膏重量损失较快,石膏的结晶水减少,逐渐转化为半水石膏;温度为150.6~309.6℃时,DTG曲线较为平缓,石膏重量损失较慢,半水膏脱水为无水石膏;309.6℃以后,石膏重量基本保持稳定。石膏结晶水质量分数为17.94%,石膏的纯度为85.72%。
工艺经过改良后,回收石膏的纯度提高了大约36.65%,极大地提高了石膏的利用价值,可代替天然石膏在某些领域的应用,如用于生产建筑石膏或生产水泥缓冲剂等对石膏品质要求较高的领域。
2.4 pH和曝气时间对废水中Fe2+/3+、Zn2+、Cu2+去除率的影响
在曝气过程中,废水pH对各金属离子的去除率存在一定影响,Fe2+在废水中有3种存在形式,分别为Fe2+、Fe(OH)+、Fe(OH)2。OH−的给电子性使中心原子更容易被氧化,因此,Fe(OH)2被氧化的速率常数比Fe(OH)+高5个数量级。提高废水pH,可加速Fe2+的氧化过程,缩短曝气时间,采用形成铁氧体和氧化沉淀的方式去除废水中的Fe3+/2+。但废水pH不宜过高,导致废水中Zn2+、Cu2+发生沉淀,沉渣中Fe的品位降低,以及后续处理中金属离子回收率降低。
控制曝气过程中废水pH分别为5、5.5、6,反应时间对废水中金属离子浓度变化的影响如图8所示。可以看出,废水中各金属离子去除率随曝气时间的增加而增加。当废水pH为5,曝气时间为30min时,废水中Fe2+/3+、Zn2+、Cu2+的去除率分别为64.2%、7.6%、20.7%,到90min时,废水中Fe2+/3+、Zn2+、Cu2+的去除率分别增加到73.5%、15.4%、58.4%,废水中仍然存在部分Fe2+/3+;当废水pH为5.5,曝气时间为30min时,废水中Fe2+/3+、Zn2+、Cu2+的去除率分别为75.6%、10.5%、35.4%,到45min时,废水中Fe2+/3+的去除率增加到95.4%左右,废水中Zn2+、Cu2+的去除率分别为22.2%、45.6%左右,此时可实现废水中Fe2+/3+的分步回收;当废水pH为6,曝气时间为30min时,废水中Fe2+/3+、Zn2+、Cu2+的去除率分别为82.4%、8.5%、43.4%,到45min时,废水中Fe2+/3+的去除率增加到92.4%,但废水中Zn2+、Cu2+的去除率较高,分别为38.4%、75.3%左右。
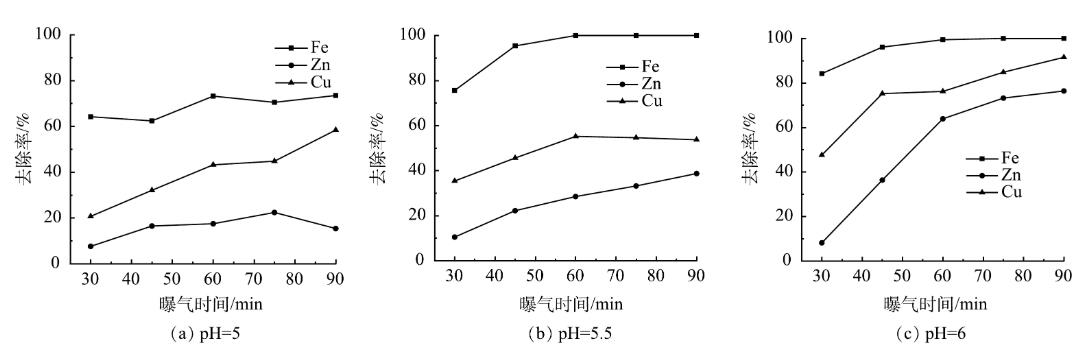
图8不同pH下曝气时间对废水中金属离子去除率的影响
在曝气过程中,控制废水的pH为5.5左右,曝气时间在45min左右时,可实现废水中Fe2+/3+的分步回收,回收沉渣中Fe的品位较高。
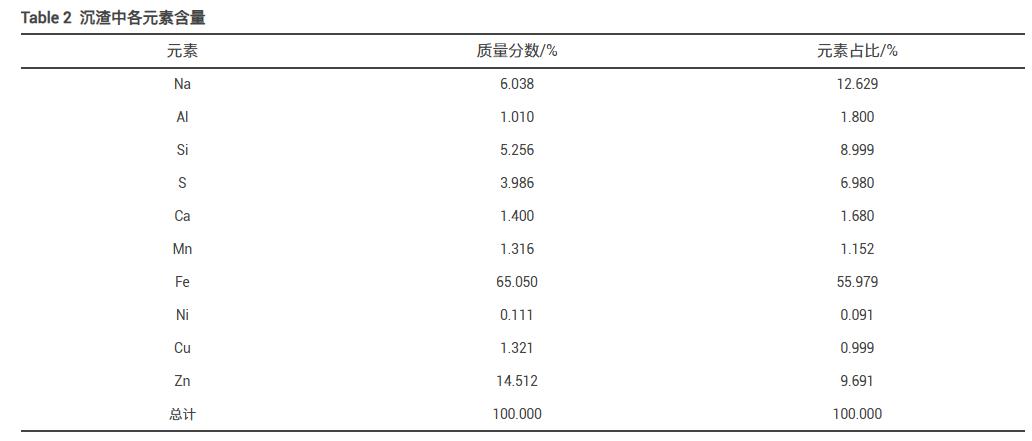
在该反应条件下,1t废水可产生沉渣铁渣1.53kg(w(Fe)=35.4%),对沉渣进行XRF分析,沉渣中各金属的含量如表2所示。沉渣中含有多种金属,如Fe、Al、Mn、Ni、Zn、Cu等,其中Fe的含量最高,质量分数可达65.05%,元素占比为55.98%,说明在曝气过程中形成了以Fe为主要成分的沉渣。
2.5 pH对废水中Fe2+/3+、Zn2+、Cu2+去除率的影响
在整个工艺中,废水中金属离子浓度变化与pH关系如图9所示。将工艺分为3个阶段来分析pH对废水中Fe2+/3+、Zn2+、Cu2+去除率的影响。
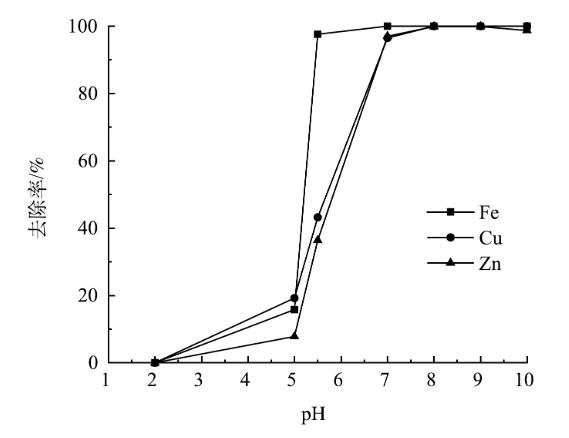
图9pH对废水中金属离子去除率的影响
第1阶段,在还原处理后的废水中投加石灰石,对废水进行中和处理并回收石膏。废水pH由2增至5时,由于废水中Fe3+被还原,在该pH范围内,废水中主要存在的Fe2+、Zn2+、Cu2+几乎不发生沉淀,且Fe2+氧化速率较低,废水中金属离子去除率较低,废水中Fe2+/3+、Zn2+、Cu2+的去除率分别为15.8%、7.8%、19.2%左右,该阶段废水中发生的反应见式(2)~式(6)。
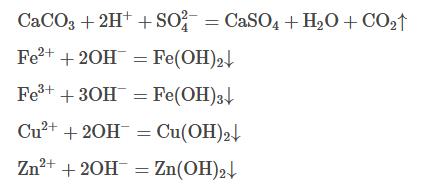
第2阶段,投加NaOH溶液,调节废水的pH至5.5并对废水进行曝气处理。采用铁氧体法合成Fe3O4,采用氧化沉淀法形成Fe(OH)3以回收废水中的Fe2+/3+。铁氧体法反应过程见式(7)。
![]()
将溶液中的Fe2+氧化为Fe3+后,与废水中剩余的Fe2+、OH−结合生成Fe3O4,氧化沉淀法则是往废水中投加NaOH,在废水种形成Fe(OH)2,再通过曝气的方式,将Fe(OH)2氧化为Fe(OH)3,反应过程见式(8)。
![]()
反应过程中生成的Fe(OH)3胶体能吸附废水中其他金属离子,这些金属离子嵌入到凝胶体结构中形成沉淀晶核,其后发生晶核生长,形成容易沉淀的大晶体从水中去除,在曝气过程中产生的大量铁凝胶为此提供了条件,故Zn2+、Cu2+的去除率也会增加。该阶段废水中的Fe2+/3+基本完全去除,废水中Fe2+/3+、Zn2+、Cu2+的去除率分别为97.6%、36.4%、43.2%左右。
第3阶段,投加NaOH溶液,调节废水的pH至9.5,回收废水中Zn2+、Cu2+。废水的pH不宜过高,当废水中的pH上升到10以上时,废水中Zn2+的去除率降低,这是由Zn(OH)2是一种两性氢氧化物,会溶于碱,故回收废水的Zn2+的过程中,废水的pH应控制为9~9.5。
2.6 氧化还原-分步沉淀处理废水效果及资源化分析
废水经过氧化还原-分步沉淀工艺处理后,废水各阶段的金属离子浓度与pH如表3所示。可以看出,废水中Fe3+/2+、Zn2+、Cu2+已基本去除,废水中Fe2+/3+的回收率为84.3%,Zn2+、Cu2+的回收率为71.2%和46.2%左右,经过二段中和处理后废水中Fe3+/2+、Zn2+、Cu2+已低于国家污水综合排放标准(GB8978-1996)。
本工艺所需药剂及费用如表4所示。按废水处理量为5×104t·d−1计算,药剂费用20.5×104元·d−1,废水的处理成本为4.1元·t−1,各药剂单价均参考工业级化学药品的价格。
在本工艺处理废水过程中,产生的可回收资源主要有石膏、铁渣和锌渣,按废水处理量为5×104t·d−1计算,本工艺可回收石膏270t,石膏纯度可达76.3%以上,可回收含铁沉渣76.5t,w(Fe)=35.4%,回收含锌沉渣70t,w(Zn)=10.89%。在AMD处理过程中,可将回收沉渣中的金属提纯,也可将沉渣作为水泥混合生产材料,或者制备无机矿物纤维,具有较高的利用价值。可回收资源的产量和市场售价如表5所示,预计产品收入为18.94×104元·d−1,处理废水收益为3.8元·t−1。
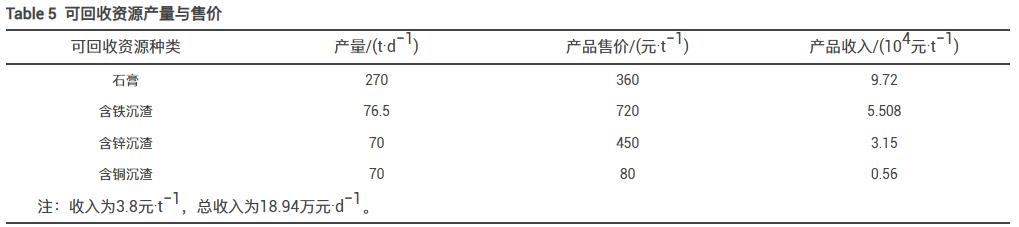
采取本工艺对废水进行处理时,废水药剂处理成本为4.1元·t−1,废水产生可回收资源产品收入为3.8元·t−1,可有效降低废水的处理成本。
3、结论
1)氧化还原-分步沉淀法通过将废水进行还原处理,再采用将石灰石进行多次中和的方式,可提高回收石膏的品质,回收石膏的工艺参数影响石膏的纯度、游离水含量、产量。正交实验确定回收石膏的最佳工艺参数:石灰石分5次投加、石灰石投加量为6g·L−1、反应时间为45min、转速为250r·min−1。该条件下回收石膏的晶体为光滑的板状,晶体粒径大,石膏的纯度提高36.65%。
2)回收石膏后,调节废水的pH至5.5,采用氧化沉淀法形成Fe(OH)3和铁氧体法形成Fe3O4的方式分步回收废水中的Fe2+/3+;继续调节废水pH至9.5,沉淀回收废水中的Zn2+、Cu2+,经处理后废水中各金属离子均低于国家污水综合排放标准(GB8978-1996),废水中Fe2+/3+、Zn2+、Cu2+回收率分别为84.3%、71.2%、46.2%。
3)氧化还原-分步沉淀法对废水进行有效处置的同时,可回收废水中的资源。该工艺可回收石膏5.4kg·t−1,石膏纯度可达76.3%,回收铁渣1.53kg·t−1,w(Fe)=35.4%,回收锌、铜渣1.4kg,w(Zn)=10.89%、w(Cu)=0.1%,废水处理的药剂成本为4.1元·t−1,废水产生可回收资源产品收入为3.8元·t−1。该工艺可降低废水的处理成本,回收废水中的资源,实现环保与经济效益双赢的目标。(来源:中山大学环境科学与工程学院,生态环境部华南环境科学研究所)
