随着乡村振兴战略的实施,农村居民的生活水平显著提高,洗衣机、热水器等家用电器的普及导致农村地区人均日用水量急增。《2020年中央一号文件》显示,我国农村地区每年产生的生活污水高达90多亿吨,由于居民居住分散及地势差异,农村污水处理设施建设难度加大,仅有部分村镇生活污水得到了集中净化。未经处理的农村生活污水含有过量的病原微生物、有机污染物和氮磷营养元素,这些污染物质的直接输入导致河流湖泊等水体富营养化,如藻类大量繁殖、氧气耗竭、生物多样性下降和淡水生态系统的广泛退化,对流域水环境造成巨大压力。目前,人工湿地、生态浮岛、生态沟渠等生物生态工程技术逐渐成为农村污水净化的有效措施。然而这些方法对土地需求较高,限制了山地丘陵区的污水净化。生物滤池凭借占地面积小、污泥产量低、高营养物去除率、易于维护运行等优点被广泛应用于丘陵山区。韩阳等对低山丘陵区的生物滤池系统进行连续一年的监测,结果表明级联生物滤池对TN、总磷(TP)的平均削减率较高,且污水净化效果主要与进水浓度、温度、生物量、水力负荷等相关。古腾等基于曝气生物滤池-模块化人工湿地组合工艺治理农村生活污水,结果表明该组合工艺具有可行性,净化效率分别为NH3-N(95.29%)、TN(67.65%)、TP(91.42%)出水水质可达GB18918—2002一级A标准。朱彬等研究不同植物类型条件下生态滤池的净化效果,结果表明菖蒲对NH3-N(92%)和TP(47%)的去除效果最佳;而风车草与菖蒲组合去除TN(49%)能力最佳。
生物滤池对污水的净化充分利用了植物、动物、浮游生物和微生物的协同作用。微生物是其中关键组成部分,通过生物吸附、生物沉淀、细胞内积累和氧化还原固定等多种机制消除水体污染物、净化水质。微生物群落与水体环境具有密切的联系,其群落组成能够反映水体环境的变化,因此水体微生物信息对于富营养化水体的治理具有重要意义。底泥作为水体污染物的“源”和“汇”,蕴含着比水体更为丰富的微生物群落,但是目前针对污水生态处理体系微生物群落组成研究较为有限,很多高效脱氮微生物难以得到有效的开发。因此,本研究利用16SrRNA扩增子高通量测序技术,以四川盆地中部丘陵区某村镇建设的一套无动力级联生物滤池系统为对象,阐明生物滤池对村镇生活污水的净化效果和不同层级生物滤池微生物群落结构差异以及主要环境因子,为明确山区生物滤池的净化机制提供科学依据
1、材料与方法
1.1 研究区概况
试验设置在四川盆地中部偏北的绵阳市盐亭县林山乡中国科学院盐亭紫色土农业生态试验站(105º27′24″E,31º16′31″N),实验所在地区地形以丘陵为主,海拔400-600m,紫色土分布广泛,属中亚热带湿润性季风气候,年平均气温17.3℃,多年平均降雨量826mm,降雨集中在每年的4-10月。林山乡面积约1.26hm2,常住人口800人,村镇分布有少量商铺和餐馆,每天大约产生30-150m3的生活污水。该地区无雨污分流系统,污水直接排入沟渠。
1.2 生物滤池
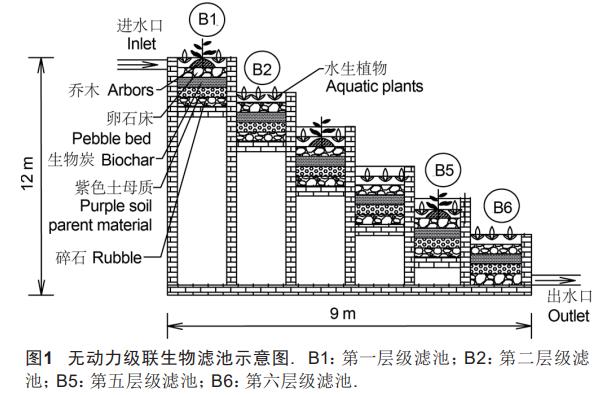
生物滤池(图1)依据地势沿坡面建设,由两栖植物反应滤池(1.5m×1.5m×1.5m)和同尺寸的水生植物反应滤池从高到低交替衔接,通过高程差形成自流跌落曝气通道,配置水陆两栖植物并形成干湿交替的氧化-还原环境。生物滤池共6个梯级,每个梯级设置3组平行反应池,按照污水水流方向依次是B1,B2,……,B6.各生物滤池底部铺设厚度为20cm的生物炭、碎石和紫色土母质;反应池中种植筛选好的、根系发达、抗污染和易于成活的水生/两栖植物,其中两栖植物反应滤池构筑中心岛,并种植小叶榕,其根系培育为蜂窝网状结构,具有大面积生物膜附着表面,同时种植高富集氮磷水生植物(铜钱草、狐尾藻),水生植物反应池内种植浮水或沉水植物(铜钱草、狐尾藻)。
1.3 样品采集及理化分析
于2019年10月至2020年9月使用干净的聚乙烯瓶采集生物滤池进水、出水样品,每隔5d采集一次。选择污水处理效果较好的夏季从B1、B2、B5、B6梯级滤池(图1)3个平行池各采集一份水样(N=12),每隔5d采集一次,持续时间一个月。用抓斗式采泥器采集B2、B5滤池内部左、中、右各采集一份底泥(N=6),放入无菌聚乙烯自封袋带回实验室,存入-20℃的冰箱用于分子生物学分析。水样采集完毕立即送到实验室分析,用0.45μm滤膜过滤后,使用流动分析仪(AutoAnalyzer3;SEAL,Germany)测定滤液NO3--N、NO2--N、NH4+-N、TDN、DOC、总溶解态磷(TDP)、正磷酸盐(PO43--P)浓度;采用碱性过硫酸钾紫外分光光度法测水样TN浓度;使用钼酸铵分光光度法测定水样TP浓度。
1.4 样品DNA提取、PCR扩增和高通量测序
随机选择夏季采集样品,其中水样经滤膜(0.22μm)抽滤,将滤膜及底泥保存在干冰箱中运送至上海派森诺生物科技股份有限公司。使用FastDNASPIN提取试剂盒(MPBiomedicals,SantaAna,CA,USA),提取细菌基因组DNA,采用NanoDropND-1000分光光谱仪(ThermoFisherScientific,Waltham,MA,USA)和琼脂糖凝胶电泳分别对提取的DNA进行定量和定性分析。以338F-806R(338F:ACTCCTACGGGAGGCAGCA;806R:CGGACTACHVGGGTWTCTAAT)为引物对细菌16SrRNA基因V3-V4多变区进行扩增;PCR反应参数如下:热循环包括98℃初始变性2min,然后25个循环,98℃变性15s,55℃退火30s,72℃延伸30s,最后72℃延伸5min。PCR扩增产物用AgencourtAMPureBeads(BeckmanCoulter,Indianapolis,IN)纯化,并用PicoGreendsDNA检测试剂盒(Invitrogen,Carlsbad,CA,USA)定量。在IllluminaMiSeq平台上,利用MiSeq试剂盒v3进行了2300bp的双末端序列测定。使用QIIMEv1.8.0处理测序数据,将与条形码精确匹配的原始测序读数分配给各自的样品并鉴定为有效序列。删除低质量的序列:长度小于150bp的序列,Phred平均值小于20的序列,含有不明确碱基的序列,以及含有单核苷酸重复序列大于8bp的序列。剩余的高质量序列通过UCLUST以97%的序列同一性聚类成可操作的分类单元(OTUs)。并选取每个OTU中丰度最高的序列作为该OTU的代表序列,进行生物信息统计分析。
1.5 数据分析
采用Origin2019b绘制生物滤池氮磷去除率变化特征图;采用SPSS21对不同层级滤池水体理化性质进行单因素方差分析,经正态性检验后使用LSD法进行差异显著性检验,显著性水平为P<0.05;使用QIIME和R(v3.2.0)“ggplot2”包进行多样性指数分析(Shannon、Simpson、Chao1、Observed_species、Faith_pd、Pielou_e)。使用R(v3.2.0)“vegan”包在OTU水平上基于Unweighted_Unifrac距离进行非度量多维尺度分析(NMDS)分析以研究不同层级生物滤池细菌群落组成差异,同时使用Adonis分析检验细菌群落差异是否显著;使用PythonLEfSe包及R(v3.2.0)“ggtree”包进行差异贡献分析(lineardiscriminantanalysiseffectsize,LEfSe),筛选不同层级滤池之间稳健的差异物种,即标志物种(biomarker)。在派森诺基因云网https://www。genescloud。cn/home进行冗余分析(RDA)用于表示细菌(属水平)和环境因子的关系。使用“psych”包进行Spearman相关分析并且使用“ggplot2”包绘制相关性气泡图。
2、结果与分析
2.1 生物滤池N、P去除率季节变化特征

通过对生物滤池进水、出水连续一年的监测(图2),发现生物滤池对污染物去除效率呈现季节波动。其中NO3--N、TN、TDN、TP的去除效率在5-8月较高,12-2月较低;对NH4+-N、NO2--N、TDP和PO43--P的去除率在9-11月较高,12-2月较低。各形态污染物年平均去除率分别为NO3--N(40.34%)、NO2--N(67.71%)、TN(34.41%)、TDN(35.40%)、NH4+-N(50.83%);TP(24.80%)、TDP(26.08%)、PO43--P(31.72%)。
2.2 不同层级生物滤池水体的理化性质

选取夏季不同层级生物滤池的水体进行理化性质分析,结果如表1所示,不同层级生物滤池水体的NO2--N、TN、TDN、NH4+-N、DOC存在显著差异(P<0.05),TP、TDP、PO43--P、NO3--N浓度差异不显著(P>0.05);其中第五、六层级滤池水体DOC、TDN、TN显著低于第一层级滤池水体,且第五、六层级滤池水体NH4+-N、NO2--N显著低于第一、二层级滤池水体(P<0.05)。结果显示在夏季降雨量增加、污染物浓度偏低情况下,生物滤池对水体富营养化元素N净化效果较P明显。
2.3 生物滤池水体及底泥细菌群落组成
采用16SrRNA高通量测序技术对生物滤池水体和底泥微生物群落组成进行分析,根据97%的相似度水平对样本OTUs进行聚类,共鉴定出细菌53个门、150纲、364目、656科、1464属。如图3A显示了水体环境相对丰度前10的优势细菌门,包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes);优势菌属主要包括假节杆菌属(Pseudarthrobacter)、黄杆菌属(Flavobacterium)、C39、不动杆菌属(Acinetobacter)、新鞘氨醇单胞菌属(Novosphingobium)(图3B)。

底泥(图3C)优势菌门主要为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria),且存在与水体细菌不同的优势菌门如互养菌门(Synergistetes)、嗜热丝菌门(Caldiserica)、Spirochaetes。在属水平上(图3D),底泥细菌组成与水体细菌不同,其优势菌属主要为鞘氨醇单胞菌属(Sphingomonas)、水小杆菌属(Aquabacterium)、绿菌属(Chlorobium)、Smithella、短波单胞菌属(Brevundimonas)。
2.4 不同层级生物滤池水体和底泥细菌群落差异

不同层级生物滤池水体及底泥细菌α多样性指数包括Chao1、Shannon、Simpson、Faith_pd指数和Pielou_E指数差异均不显著(P>0.05)。NMDS分析发现不同层级生物滤池水体和底泥细菌群落组成区分明显(图4,Adonis分析,P=0.001),其中第一层级滤池水体细菌与其他层级区分最为明显,第五、六层级水体细菌群落组成较为相似。
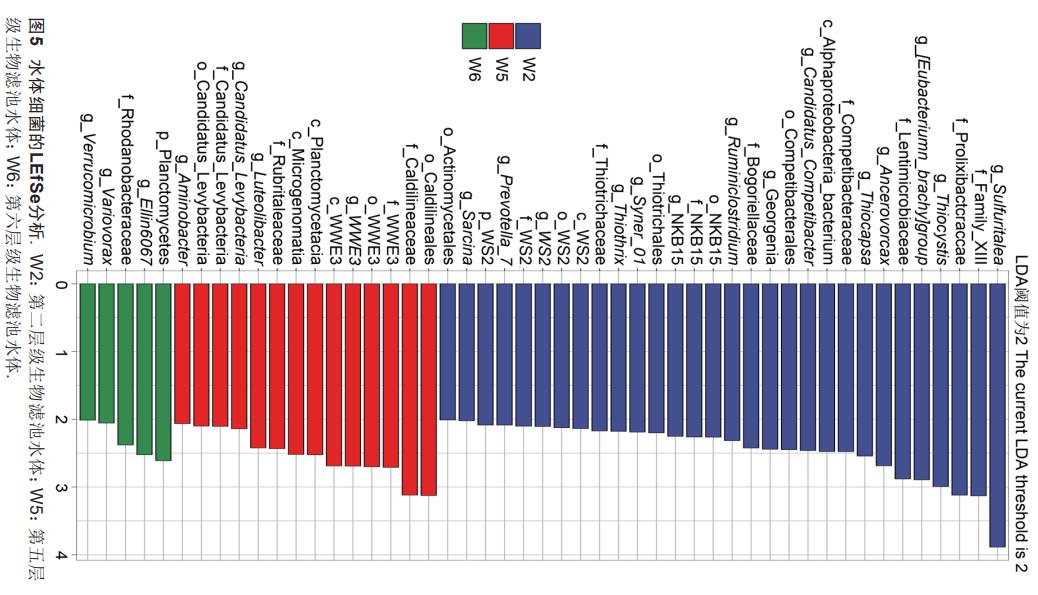
为进一步研究不同层级生物滤池水体微生物群落组成差异,采用LEfSe分析检测潜在生物标志物(图5,LDA阈值为2)。不同层级生物滤池之间共发现49个细菌类群丰度存在显著差异(P<0.05)。其中第一层级滤池水体中没有显著的生物标志物。第二层级滤池水体的生物标志物类群最多,包括Gamma-proteobacteria纲(发酵杆菌目Thiotrichales、Competibacterales目、Competibacteraceae科、Candidatus_Competibacter属、丝硫细菌科Thiothrix、荚硫菌属Thiocapsa、Sulfuritalea属),厚壁菌门Firmicutes(FamilyXIII科、瘤胃梭菌属Ruminiclostridium、八叠球菌属Sarcina、Anaerovorax属),拟杆菌门Bacteroidetes(Prolixibacteraceae科、普雷沃菌属Prevotella_7、Lentimicrobiaceae科),互养菌门Synergistetes(Syner_01属),放线菌门Actinobacteria(博戈里亚湖菌科Bogoriellaceae、放线菌目Actinomycetales、Georgenia属),WS2门(WS2纲、WS2目、WS2科、WS2属),Deltaproteobacteria(NKB15目、NKB15科、NKB15属)。第五层级滤池水体生物标志物包括髌骨细菌门Patescibacteria(Microgenomatia纲、Candidatus_Levybacteria目科属、WWE3纲目科属),氨基杆菌属Aminobacter,疣微菌门Verrucomicrobia(Rubritaleaceae科、Luteolibacter属),绿弯菌门Chloroflexi(暖绳菌目Caldilineales、暖绳菌科Caldilineaceae),浮霉菌纲Planctomycetacia。第六层级滤池水体的生物标志物为Gamma-proteobacteria纲(罗丹诺杆菌科Rhodanobacteraceae、Ellin6067属、贪噬菌属Variovorax),疣微菌门Verrucomicrobia(疣微菌属Verrucomicrobium),浮霉菌门(Planctomycetes)。
2.5 水体细菌群落与环境因子之间的关系
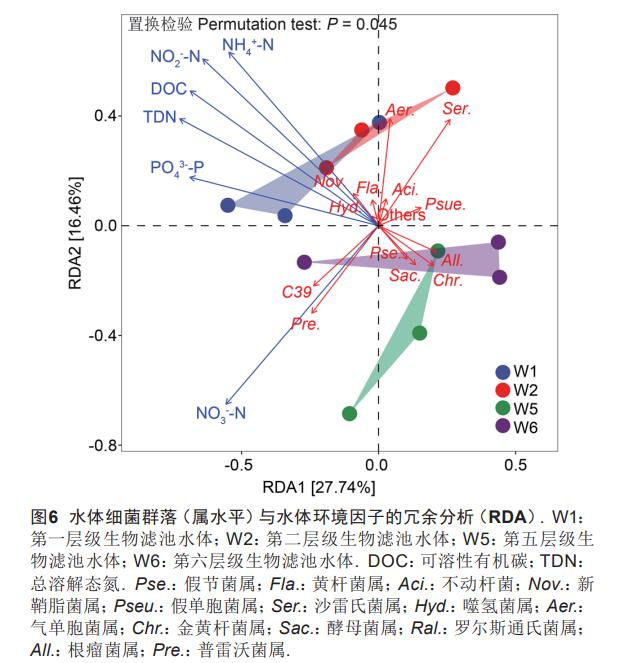
选择相对丰度前15的细菌群落(属水平)与水环境因子进行冗余分析,结果(图6)显示,环境因子共同解释了细菌群落差异的48.2%,其中第一轴和第二轴分别解释了27.74%和16.46%,DOC、TDN、NO2--N、NH4+-N、NO3--N对微生物群落作用显著(P<0.05),第一、第二层级滤池与第五、第六层级滤池的水体微生物群落被这些显著的环境因子区分开。
TDN、DOC、NO2--N、NH4+-N与新鞘脂菌属Novosphingobium、黄杆菌属Flavobacterium、噬氢菌属Hydrogenophaga、气单胞菌属Aeromonas、不动杆菌属Acinetobacter显著正相关(P<0.05),而与Saccharimonadales、假节菌属Pseudarthrobacter、金黄杆菌属Chryseobacterium、根瘤菌属Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、罗尔斯通氏菌属Ralstonia、假单胞菌属Pseudomonas显著负相关(P<0.05);NO3--N与大部分优势菌属负相关(P<0.05),与普雷沃菌属Prevotella_9、假节菌属Pseudarthrobacter、Saccharimonadales显著正相关(P<0.05)。
2.6 氮转化功能微生物
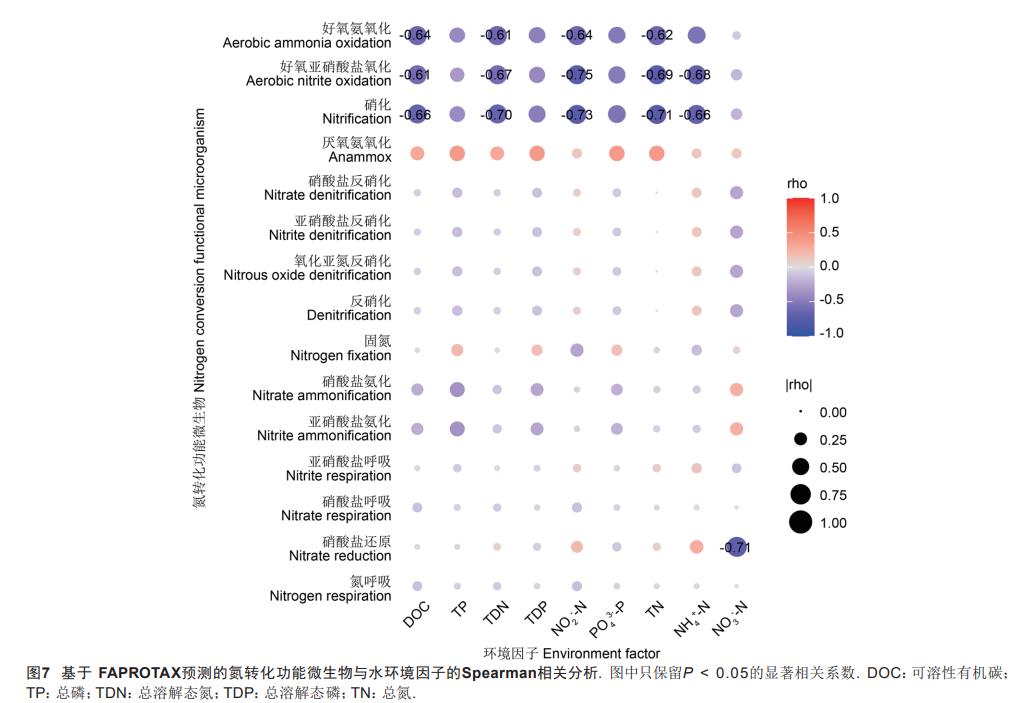
不同层级生物滤池对水体富营养化元素氮去除能力较磷显著,为进一步探究氮转化相关微生物与环境因子之间的关系,采用FAPROTAX对水体细菌群落功能进行注释,将获得的15个氮转化相关功能类群与水环境因子进行Spearman相关分析(图7),结果显示好氧氨氧化微生物与水体DOC、TDN、NO2--N、TN显著负相关(P<0.05);好氧亚硝酸盐氧化微生物、硝化作用微生物与DOC、TDN、NO2--N、TN、NH4+-N显著负相关(P<0.05);硝酸盐还原微生物与NO3--N显著负相关(P<0.05)。
3、讨论
3.1 生物滤池对生活污水的净化效果
生物滤池对污水氮磷去除率随着季节变化,整体表现为春夏秋季去除率高而冬季去除率最低;前人研究也发现季节间污染物的去除差异体现在温度的显著变化,系统内微生物活性受限于温度,尤其是硝化和反硝化细菌,对温度变化非常敏感,该地区冬季水温常低于10℃,在10℃以下时硝化和反硝化细菌的代谢和活性趋于下降,脱氮效率受到抑制。总体而言生物滤池对NO3--N(40.34%)、NO2--N(67.71%)、NH4+-N(50.83%)的去除效果较好,且整年脱氮效果相对磷明显
3.2 生物滤池水体和底泥细菌群落组成
生物滤池的稳定性是由优势微生物维持的,在本研究中变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)是各层级生物滤池水体和底泥样本的优势菌门,在细菌群落中占主导地位。变形菌门细菌繁殖速度快,α-Proteobacteria、β-proteobacteria、δ-Proteobacteria和γ-Proteobacteria是富营养化环境中典型的细菌群落,其中包括丰富的硝化、反硝化、厌氧氨氧化和亚硝酸盐氧化细菌,是有机物降解和硝化、反硝化等脱氮过程的主要参与者。先前的研究也表明变形菌门(Proteobacteria)在农村生活污水、淡水、污水处理厂、海洋沉积物、湿地和湖泊沉积物等环境中占据主导地位,显示了其广泛的分布。陈月芳等研究生物滤池对农村生活污水的净化也发现Proteobacteria是最优势菌门,显示了其广泛的分布。Wu等对全球269个污水处理厂的细菌群落的全球多样性研究发现Proteobacteria占总体细菌群落82%,展现了其绝对优势。王倩等对汾河沉积物的研究也表明变形菌门是优势类群。绝大多数放线菌(Actinobacteria)为好氧或微好氧菌,其下某些属如分枝杆菌属(Mycobacterium)具有脱氮功能,还能够参与有机物的分解和矿化。拟杆菌门(Bacteroidetes)是专性厌氧微生物,常用于指示作为水体粪便污染,研究发现拟杆菌门在生物脱氮的过程中发挥重要的作用;厚壁菌门(Firmicutes)能在有氧或缺氧的环境中进行代谢,并参与了硝化、反硝化过程。本研究发现的优势菌门具有生物脱氮功能,这可能是生物滤池对N污染物消减效率较高的重要因素。本研究中发现的多个优势属在有机物降解和脱氮作用中也有报道:黄杆菌属(Flavobacterium)是一种常见的异养反硝化菌,常出现在富含硝酸盐的富营养水体中,同时它在有机物降解和碳循环中起着关键作用。不动杆菌属(Acinetobacter)是一种异养硝化-好氧反硝化细菌,具有很好的脱氮性能。新鞘氨醇单胞菌(Novosphingobium)是鞘氨醇单胞菌(Sphingomonas)划分出来的新属,该菌属广泛存在于水体和底泥环境中,并且大多数都与有机污染物如多环芳烃、β-环柠檬醛、雌激素等的降解有关。气单胞菌属(Aeromonas)是一类兼性厌氧菌,可还原硝酸盐为亚硝酸盐。RDA分析显示这些优势菌属与NO3--N显著负相关,表明硝态氮浓度显著影响这些反硝化功能菌。假单胞菌属(Pseudomonas)是一种异养硝化好氧反硝化菌,该菌与TDN、DOC、NO2--N、NH4+-N显著负相关,说明污水的这些污染物含量高可能抑制该菌的繁殖。本研究的优势菌门和菌属在污水脱氮方面发挥重要的作用。
3.3 生物滤池水体和底泥细菌群落差异
不同层级生物滤池水体细菌群落组成存在显著差异(NMDS分析,Adonis分析),RDA分析也显示污水NO2--N、TDN、NH4+-N、DOC对水体细菌群落结构影响显著。第一、二层级生物滤池污水NO2--N、TDN、NH4+-N、DOC浓度偏高,其中第二层级生物滤池生物标志物数量也较多(图5),存在多种硝化细菌,以γ-变形菌Gamma-proteobacteria占优势,并且也发现多种放线菌门(Actinobacteria)、厚壁菌门(Firmicutes),这类好氧或者兼性脱氮菌主要通过好氧氨氧化、好氧亚硝酸盐氧化和硝化作用降解污水DOC、TDN、NO2--N、TN、NH4+-N(图7);此外还存在互养菌门(Synergistetes),此类菌的所有菌种均参与了氨基酸的降解过程中。经过上层生物滤池的净化,第五、六层级滤池水体N污染物浓度下降,标志性菌种数量也减少,第五层级滤池水体典型的生物标志物有绿弯菌门(Chloroflexi),研究表明绿弯菌门的分布极为广泛,在普通环境到极端环境均有分布,并参与了硝化作用的第二步,即NO2--N的氧化过程。此外第五、六层级滤池水体中还共同出现了多种厌氧菌:浮霉菌门(Planctomycetes)是典型的厌氧氨氧化细菌,广泛存在于淡水水体、污水处理系统等各种厌氧环境中,其大部分种类对污水氨氮及亚硝酸盐有较好的去除作用。疣微菌门(Verrucomicrobia)是革兰氏阴性细菌,广泛存在于海洋、土壤和人体肠道中,能够在厌氧条件下进行亚硝化作用。第二层级滤池水体的优势好氧和兼性脱氮菌与第五、六层级滤池水体优势厌氧菌的存在可能是导致上层滤池与末端滤池细菌群落结构差异的重要因素,第五、六层级滤池水体滤池中的多种厌氧菌也加快了污水氨氮和亚硝酸盐的去除过程。
底泥和水体细菌群落存在显著差异(P=0.001),这与其他人研究一致。底泥作为环境物质和底栖生物的重要载体,不仅富集大量的氮、磷营养元素,而且蕴含着比水体更丰富的微生物,与上覆水体进行着频繁的能量和物质交换,使得底泥成为水体污染的潜在来源。底泥中的地球化学元素循环影响其微生物的多样性,而底泥中微生物群落的改变又会影响水生生态系统中物质迁移和转化,在一定程度上影响着水体微生物群落结构;同时,水质的变化也会促使底泥微生物群落发生改变。因此,底泥和水体微生物群落均是水生生态系统环境变化的重要指标,研究底泥与水体微生物群落对阐明营养物质循环和水体净化具有重要意义。
3.4 生物滤池水体细菌氮转化功能预测
FAPROTAX是目前广泛运用的原核微生物分类的功能注释数据库,覆盖了4600多个不同的原核微生物,对环境样本中原核微生物的生物化学循环过程(碳、氢、氮、磷、硫等元素循环)进行功能注释预测,其预测准确性较好。本研究分析结果显示生物滤池中污水TN、TDN、NO2--N的去除与好氧氨氧化、好氧亚硝酸盐氧化、硝化作用显著相关(P<0.05),NH4+-N的去除与好氧亚硝酸盐氧化、硝化作用显著相关(P<0.05)。硝化作用由一类化能自养好氧的硝化细菌完成,氨氧化过程是硝化过程的限速步骤,多数氨氧化细菌属于Betaproteobacteria和Gamma-proteobacteria类;亚硝酸盐氧化作用是硝化反应的第二阶段,已报道的归类于变形菌门(Proteobacteria)、硝化刺菌门(Nitrospinae)、绿弯菌门(Chloroflexi)和硝化螺旋菌门(Nitrospirae)。本研究中变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)均是水体和底泥细菌的优势菌门(图3),在好氧氨氧化和亚硝酸盐氧化过程中发挥了重要作用。硝酸盐还原作用主要在缺氧或者厌氧条件下反硝化菌将NO3--N还原为N2O或N2,本研究结果发现该过程与NO3--N显著负相关(P<0.05),优势厌氧/兼性菌如拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)在反硝化过程中也发挥了重要作用。生活污水氮素污染主要以氨氮和有机氮形态存在,研究也发现生物滤池的脱氮过程以好氧硝化反应占优势(图7),生物滤池跌落曝气的设计以及水生/两栖植物的种植利于营造好氧状态,加快污水TN、TDN、NO2--N、NH4+-N的去除过程。
4、结论
本研究通过对生物滤池污水净化的连续监测,发现生物滤池对NH4+-N、NO2--N年平均去除率达到50%以上。这些氮素污染物的去除过程主要由好氧氨氧化、好氧亚硝酸盐氧化和硝化作用微生物共同参与,生物滤池内的优势菌门和菌属在这些过程中也发挥了重要作用。不同层级生物滤池污水TN、NH4+-N、DOC、TDN、NO2--N差异显著(P<0.05),同时层级间生物滤池微生物β多样性差异显著,上层滤池水体(W2)优势菌以好氧和兼性菌为主,下层滤池水体(W5、W6)存在优势厌氧菌,这是生物滤池层级间细菌群落组成的重要差异,可能与层级间污水氮素污染物的形态及浓度变化有关。研究结果为深入探讨生物滤池脱氮的微生物机制提供了科学数据,并可为村镇生物滤池的构建提供微生物信息参考。本研究仅采集第二层和第五层生物滤池的底泥样品,尚未能开展底泥与水体微生物内在联系的研究,同步研究底泥和水体微生物群落及代谢特征对揭示生物滤池污水净化的微生物作用机制将具有重要价值。(来源:中国科学院成都山地灾害与环境研究所,中国科学院山地表生过程与生态调控重点实验室,中国科学院大学,中国三峡建工(集团)有限公司)
