1 引言(Introduction)
环丙沙星(Ciprofloxacin, CIP)又被称为环丙氟哌酸, 是一种典型的人工合成的氟喹诺酮抗生素药物.CIP的分子式为C17H18FN3O3, 相对分子量为331.35, 因其具有较强的杀菌作用(Leal et al., 2012)而被广泛用作治疗和预防人类和动物疾病的抗菌药.其杀菌效果是诺氟沙星及依诺沙星的2~4倍, 对流感嗜血杆菌、肠杆菌、绿脓杆菌、链球菌、淋球菌、金黄色葡萄球菌、军团菌均具有抗菌作用.据报道, 2013年中国使用了大约5340 t CIP, 这是所有氟喹诺酮类抗生素中使用量第二高的抗生素(Zhang et al., 2015).CIP的大量使用使得一些致病菌产生耐药性, 长期存活于环境中会威胁人类健康.此外, CIP能促进抗性基因(ARGs)的产生, 抗性基因的传播和扩散可能会加快抗药性菌群的大量繁殖(Sapkota et al., 2007)并对微生物群落结构形成潜在威胁, 进而对人类健康和生态环境安全构成二次威胁(葛伟丽, 2014).
由于人们对抗生素的过度依赖和大量使用, 导致大量抗生素进入环境成为新型污染物, 威胁着环境和人类健康.据报道, 抗生素进入机体后, 停留时间很短并且只有很少一部分被吸收进生物体进行新陈代谢, 60%~90%的抗生素以原型或其代谢产物的形式随粪尿排出体外(王佳宁等, 2017), 最终通过医院废水、养殖废水、生活污水等途径进入环境, 其中, 污水处理厂是环境抗生素的主要来源之一.据报道, 85%以上的CIP常以原形及其代谢产物的形式通过污水处理、动物粪便等进入环境.近年来, CIP在水体、土壤及植物等环境介质中被广泛检出(邰义萍等, 2010;王桥军等, 2009;陈涛等, 2010;Ji et al., 2014;Chang et al., 2016).目前在水中检测到的CIP浓度范围已由ng · L-1、μg · L-1级别发展到mg · L-1级别.在一些医院废水中CIP浓度为21 μg · L-1(Doorslaer et al., 2014), 但从其相关的生产废水中检测出浓度高达4.9 mg · L-1(Babić et al., 2013).Tong等(2009)在2009年通过对湖北省多处地表水和地下水的水质进行检测分析, 发现在地表水中CIP浓度在0.007~0.012 μg · L-1之间, 而在地下水中检测到的CIP浓度为7.2~8.4 ng · L-1.此外, 在污水处理系统中也常检测到CIP的存在, 我国污水处理厂出水中CIP的最高检出浓度为1323 ng · L-1, 其中, 广州地区的检出浓度高于我国其他地区.国外污水处理厂出水中, 巴西的污水处理厂出水中CIP检出浓度为2378 ng · L-1(Rosal et al., 2010), 高于已报道的美国威斯康星州(Karthik Eyan et al., 2006)和瑞典(Lindberg et al., 2005)的浓度水平及我国污水处理厂出水中的浓度水平.芬兰的污水处理厂出水中CIP检出浓度最高达4230 ng · L-1(Vieno et al., 2007).根据研究者对长沙地区的调查, CIP在湘江中的浓度为0.03~0.15 μg · L-1, 在捞刀河中的浓度为0.02~0.34 μg · L-1, 在污水处理厂的进水浓度达到0.01~0.8 mg · L-1.
污水处理厂不仅是抗生素的重要来源, 同时由于微生物暴露在含高浓度的抗生素废水中, 抗性基因也会伴随产生(Guo et al., 2017), 因此, 污水处理厂在消除抗生素方面具有重要作用(Suarez et al., 2008), 是污染物进入水环境前的最后一道防线.一方面, 污水处理厂对抗生素有一定的吸收和分解作用;另一方面, 这些污染物对污水处理厂的正常运行也存在一定的影响.因此, 本研究在实验室序批式反应器(SBR)处理模拟生活废水的基础上, 探究CIP与活性污泥之间的相互作用及对废水处理过程中行为的影响.通过CIP的去除实验验证其主要的去除方式, 以及对污泥性能和活性产生的影响;在CIP短期和长期暴露实验中, 考察CIP不同浓度、不同暴露时间对污水处理功能的影响;同时, 通过测定一个反应周期中NH4+-N、NO3--N、NO2--N、PO43--P、聚羟基脂肪酸酯(PHA)、糖原质的含量及乳酸脱氢酶(LDH)释放量和污泥活性, 考察CIP对SBR的影响机理.以期为评估CIP及其他新型污染物在污水处理厂中的行为提供一定的理论依据.
2 材料和方法(Materials and methods)
2.1 药品
环丙沙星(Ciprofloxacin, CIP)为分析纯(纯度>98%), 购买自南京京德宝生化器材有限公司;甲醇为HPLC级试剂;其余化学试剂均为分析纯.实验之前配置1000 mg · L-1的CIP储备液备用.根据之前CIP在城市污水中的检出浓度及抗生素类药物使用量的增加, 本研究设置了不同浓度CIP来探究CIP对SBR潜在的毒性影响(表 1).
表 1 各SBR反应器内CIP剂量的设置情况
2.2 序批式反应器(SBR)运行
实验所用的接种泥取自长沙市污水处理厂的二沉池.实验之前用蒸馏水洗涤3次, 浓缩后放入4 ℃冰箱中保存, 种泥中CIP浓度未被检测出.SBR反应器的工作体积为22 L, 温度控制在(22±1) ℃, 混合液有机悬浮固体浓度(MLVSS)控制在3000~3500 mg · L-1, 每天包含3个周期的循环, 每个周期包含厌氧阶段(90 min)、好氧阶段(150 min)和缺氧阶段(120 min).好氧阶段使用曝气设备进行曝气, 流量控制在35 L · min-1.此外, 还包含沉淀阶段(55 min)、排水阶段(5 min)和闲置阶段(60 min).反应过程中使用搅拌器进行搅拌(除了沉淀、排水和闲置阶段), 沉淀阶段之后排出上清液15 L.在厌氧阶段最初的5 min内加入15 L合成废水并维持系统pH为7.0±0.2.在缺氧阶段之后和沉淀阶段之前排出1.5 L混合物以维持系统中污泥的停留时间(SRT)大约为15 d, 水力停留时间(HRT)为12 h.运行150 d之后, 反应器中氮、磷去除率都达到99%左右, 表明SBR的运行为稳定状态.
采用合成废水进行模拟实验.水质特性(平均)为:化学需氧量(COD)250~300 mg · L-1, 氨氮(NH4+-N) (35±1.75) mg · L-1, 溶解性磷(SOP) (10±0.5) mg · L-1.以乙酸钠(384.6 mg · L-1)作为碳源, NH4Cl(114.4 mg · L-1)为氮源, 同时包含适量Mg、Ca等矿物质元素.此外, 还包含适量微量元素:0.03 mg · L-1 CuSO4 · 5 H2O、0.06 mg · L-1 Na2MoO4 · 2 H2O、0.12 mg · L-1 ZnSO4 · 7 H2O、0.12 mg · L-1 MnCl2 · 4 H2O、0.15 mg · L-1 H3BO3、0.15 mg · L-1 CoCl2 · 6 H2O、0.18 mg · L-1 KI、1.5 mg · L-1 FeCl3 · 6 H2O、10 mg · L-1 EDTA.使用1.0 mol · L-1的NaHCO3和1.0 mol · L-1 HCl调节初始pH为7.0±0.2.
2.3 SBR对CIP吸附降解影响实验
从稳定运行阶段的母反应器中取适量污泥混合物, 均匀分为6等份并转移到6个相同的SBR反应器内, 每个反应器的工作体积为3 L, 这6个反应器与母反应器运行条件相同;使用CIP储备液分别配置浓度为0、0.003、0.03、0.3、3和6 mg · L-1的CIP使用液, 并加入到反应器内, 进行一次长期实验, 测定固相和液相中CIP的含量.
2.4 CIP在SBR系统中的短期/长期暴露实验
为了进行CIP暴露实验, 在4个相同的工作体积均为3 L的SBR反应器内, 分别加入等体积从母反应器(稳定运行时期)内排出的污泥混合物.运行适应1个星期之后, 向4个SBR反应器中投加适量的CIP储备液, 控制CIP浓度分别为0(空白)、0.05、0.5、5 mg · L-1.其余操作条件及加入合成废水含量和组分均与上述SBR序批式反应条件相同.短期暴露的时间为1个周期(8 h), 在1个周期内每30 min测一次出水中的NH4+-N、NO3--N、NO2--N、PO43--P、PHA和糖原质含量, 同时测定污泥活性和LDH的释放量, 以此来反映不同浓度CIP对SBR的影响.长期暴露实验则是在每个周期反应器中加入不同浓度的CIP, 每2 d测定一次出水中NH4+-N、NO3--N、NO2--N、PO43--P含量变化, 来说明不同浓度CIP对SBR的长期影响.运行90 d之后, 通过测定一个周期内上述指标及PHA、糖原质含量、污泥活性和LDH释放量来反映CIP对SBR的影响机理.为了进一步研究CIP对污泥微生物的影响, 同时对相关酶活性进行测定.
2.5 分析检测方法
2.5.1 指标检测方法
NH4+-N、NO3--N、NO-2-N、PO43--P、SVI、COD、混合液悬浮固体(MLSS)和混合液挥发性悬浮固体(MLVSS)根据标准方法进行分析(APHA, 1998).糖原的测定采用高效液相色谱法(Agilent 1200, USA), 具体操作参照文献内容(Pijuan et al., 2010).胞内聚合物聚羟基脂肪酸酯(PHA)采用气相色谱法进行测定, PHA的测定包含聚羟基丁酸酯(PHB)、聚羟基戊酸酯(PHV)、聚羟基戊酸甲酯(PH2MV), 具体方法参照文献(Chen et al., 2015).相关酶包括磷酸激酶(PPX)、外切聚磷酸酶(PPK)、氨单加氧酶(AMO)、硝酸还原酶(NAR)和亚硝酸盐还原酶(NIR)的测定参照相关文献(Louvet et al., 2010).LDH的释放量采用细胞毒性检毒箱(瑞士罗氏分子生化药剂)进行检测, 污泥活性采用细胞计数箱(日本同仁化学研究所)进行检测, 使用方法均依据厂商说明.
2.5.2 CIP检测方法
液相中, 加入不同浓度CIP的SBR反应器运行稳定后, 取适量出水在4 ℃、4000 r · min-1条件下离心10 min, 取上清液, 过0.45 μm滤膜, 然后过HLB固相萃取小柱净化富集.HLB萃取小柱在使用前依次用10 mL高纯水和10 mL甲醇进行活化.将滤液加入已活化的萃取小柱, 控制上样速度为2 mL · min-1, 上样完毕, 用20 mL高纯水淋洗萃取柱后静置10 min, 氮气吹扫柱子30 min, 用12 mL的甲醇:乙腈(1 : 1, V/V)溶液洗脱小柱, 收集洗脱液, 并将其在40 ℃水浴下用氮气吹至近干;然后用色谱甲醇-高纯水(60 : 40, V/V)定容至1 mL, 振荡混匀, 过0.22 μm滤膜, 处理好的样品密封避光储存在-20 ℃的环境下, 待测(何势, 2016;戴琦, 2017).
固相中, 污泥样品需进行下述准备:冻干的污泥样品首先放入塑料离心管内, 每一根离心管内加入10 mL 5%的甲醇溶液, 使用漩涡混合器混合1 min, 在50 ℃的条件下超声处理5 min;随后将样品放入离心机在转速为4000 r · min-1的条件下离心处理5 min, 将上层清液转移到离心管内, 重复上述步骤处理底部的剩余残渣, 并将多次处理后的上清液混合.取10 mL提取液在50 ℃的微弱氮气条件下吹至近干, 剩余物用1 mL流动相溶解, 溶液使用0.22 μm有机滤膜过滤到2 mL采样瓶内, 待测(Zhang et al., 2014; 戴琦, 2017).
CIP浓度采用高效液相色谱仪HPLC(LC-2010A型, 日本岛津)测定, 色谱柱为ODS-2(5 μm 4.6 nm×250 mm, WondaCract, 日本岛津), 检测器为紫外可见吸收检测器(UV-Vis), 波长为277 nm, 流动相为色谱纯乙腈:水(含0.1%甲酸, 色谱纯)=20 : 80(体积比), 流速为0.7 mL · min-1, 温度为35 ℃, 进样体积为10 μL, 根据峰面积计算出其含量.CIP的质量平衡使用以下公式进行计算:
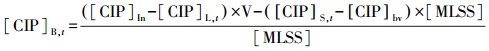
式中, [CIP]In为循环最初CIP的浓度(mg · L-1);V为SBR的工作体积(L);[MLSS]为混合液悬浮固体(g · L-1);[CIP]bv为循环开始活性污泥中CIP的背景浓度;[CIP]L, t为一定时间点CIP在液相中的浓度(mg · L-1);[CIP]S, t为一定时间点CIP在固相中的含量(μg · g-1);[CIP]B, t为CIP在相同的时间点可能的生物降解量(μg · g-1).
3 结果与讨论(Results and discussion)
3.1 CIP在SBR系统中的吸附降解
通过比较长期运行后各系统进水和出水中CIP的浓度变化可知, CIP的去除率随浓度变化存在差异.当CIP的浓度分别为0.003、0.03和0.3 mg · L-1时, 去除率大约为90%, 但当CIP浓度增至3和6 mg · L-1时, 出水中CIP的浓度分别降至(0.945±0.038)和(4.224±0.169) mg · L-1, 去除率分别下降到68.5%和29.6%.说明SBR系统虽然对CIP有一定的去除, 但其去除量有限.CIP可能的去除途径有两种:活性污泥吸附与生物降解.为了更好地研究其去除机制, 本研究分析了CIP在各系统中的质量变化情况.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
表 2显示了CIP在生物处理过程中各系统的质量平衡状况.可以看出, 在所有的SBR系统中, CIP在液相中减少的部分主要转移到了固相.随着进水中CIP浓度的升高, 总CIP在反应过程中的损失率始终维持在11%~13%左右, 说明进水中CIP的主要去除途径是生物吸附但同时生物降解也有一定的潜力.可能是随着CIP浓度的升高, 系统中富集了降解CIP的微生物, 一部分CIP被微生物降解.当进水CIP质量分别为0.009、0.09和0.9 mg时, 出水中CIP含量较低, 而当进水CIP质量分别为9和18 mg时, 出水中CIP含量较高.说明活性污泥在SBR系统中对CIP有一定的吸附作用, 但高含量CIP(9和18 mg)在生物脱氮除磷系统中很难被去除, 这一结果与相关文献报道相一致(Li et al., 2010;Girardi et al., 2011;Mougin et al., 2013).相关实验室的吸附研究也证实了CIP被好氧生物体吸附的潜力(Wu et al., 2009).CIP进入污水处理厂的质量流量分析同样表明, 大约80%流入的CIP与厌氧消化污泥有关(Golet et al., 2003;Lindberg et al., 2006).以上研究表明, 活性污泥对污水中的CIP有一定的去除性能, CIP的去除主要是通过活性污泥吸附的形式实现.
表 2 稳定运行系统中CIP的质量平衡情况
3.2 CIP暴露对活性污泥性能的影响
上述实验已经证实CIP的主要去除途径为污泥吸附, 而CIP作为抗菌剂也有可能对污泥活性造成一定的影响.已有研究表明, 通常使用细胞增殖和LDH的释放来表征有毒物质对细胞生长和活性的影响(Mosmann, 1983).其中, LDH是存在于细胞质的一种酶, 当细胞膜受到损伤时, LDH会释放到培养基中.由于释放出的LDH稳定, 检测培养基中LDH的量可以作为测定死细胞和受损细胞数量的指标.因此, 本研究对这两者均进行检测分析.
从图 1中可以看出, CIP长期暴露实验和短期暴露实验对污泥活性和细胞完整性均无显著影响.其中, 高浓度(5 mg · L-1)与低浓度(0.05 mg · L-1)暴露实验中, 均未明显检测出LDH, 同时两浓度下细胞生存能力无明显差异.由此可见, CIP对活性污泥细胞的完整性及细胞活性均无显著影响.
图 1

图 1活性污泥中LDH的释放量及细胞生存能力(a.CIP短期暴露实验, b.CIP长期暴露实验)
污泥体积指数(SVI)是判断污泥沉降浓缩性能的一个重要参数, 通常认为SVI值为100~150 mL · g-1时, 污泥沉降性能良好;SVI值>200 mL · g-1时, 污泥沉降性能差;SVI值过低时, 污泥絮体细小紧密, 含无机物较多, 污泥活性差.由图 2可以看出, 随着CIP浓度的增大, 污泥SVI值显著降低.与空白组相对照, 当CIP浓度为5 mg · L-1时, SVI值降低最明显(从~115 mL · g-1下降到~75 mL · g-1).实验结果表明, 在CIP长期暴露条件下, 活性污泥沉降性能会显著提高.然而, 过低的SVI值通常表明污泥的活性不高, 这说明高浓度的CIP对活性污泥中微生物的代谢和增殖具有一定的影响, 从而对活性污泥的功能也会产生一定的抑制作用.
图 2
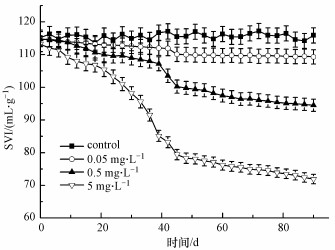
图 2 CIP长期暴露后活性污泥SVI值的变化
3.3 CIP长期/短期暴露对生物脱氮除磷的影响
实验结果显示了一个周期内TP和TN的变化, 可以看出, CIP浓度分别为0.05、0.5、5 mg · L-1时, 短期暴露对生物脱氮除磷的影响不明显, 与空白对照组基本一致(图 3a).在长期暴露实验中, 随着CIP浓度的升高, 氮和磷的去除效率均呈下降趋势(图 3b).由于本实验采用的是模拟生活污水, 且所配置的污水中具有合理的碳、氮、磷比值, 因此, 在空白组实验中TP和TN具有良好的去除性能, 去除效率分别为97.1%±1.2%、96.1%±1.1%.当CIP浓度为0.05 mg · L-1时, TP和TN的去除率分别降为95.8%±0.9%、94.6%±0.8%.继续增加CIP浓度至0.5和5 mg · L-1时, TP、TN的去除率分别降为89.1%±0.6%、87.9%±0.4%(0.5 mg · L-1)和74.3%±0.7%、70.2%±0.6%(5 mg · L-1).结果表明, 活性污泥短期暴露于CIP环境中, 对氮和磷的去除并无不利影响, 但长期暴露会显著降低氮和磷的去除效率.对于如何影响氮和磷的去除将在接下来的实验中详细讨论.
图 3

图 3 CIP暴露实验对生物脱氮除磷效率的影响(a.CIP短期暴露, b.CIP长期暴露)
3.4 CIP对生物脱氮除磷的影响机制
通过检测CIP暴露90 d内出水中SOP、NO3--N、NH4+-N、NO2--N的浓度可以看出, 氮和磷的去除变化在第3 d时较为明显(图 2), 此时SOP的浓度随CIP浓度的增高而增高, 当CIP浓度分别为0、0.05、0.5、5 mg · L-1时, SOP的浓度分别为0.37、0.47、0.94和2.42 mg · L-1, 说明CIP的存在抑制了SOP的去除, 且随浓度升高抑制作用加强(图 4a).但CIP浓度变化对NO3--N浓度变化的影响较小, 此时NO3--N的浓度分别为0.40、0.41、0.42和0.45 mg · L-1(图 4b), NH4+-N的浓度分别为0.61、0.63、0.67和0.70 mg · L-1, 说明CIP对NH4+-N的影响同样不明显(图 4c).另外, CIP浓度变化对NO2--N的影响趋势同SOP一样, 此时浓度分别为0.32、0.67、2.5和5.2 mg · L-1(图 4d).CIP暴露反应持续90 d左右, 最终在暴露浓度为0~5 mg · L-1的反应器中, SOP的浓度分别为0.49、0.50、0.91和2.44 mg · L-1.NO3--N与NH4+-N的浓度变化不大, NO2--N的浓度变化趋势同SOP一样, 分别为0.34、0.65、2.20和6.10 mg · L-1.
图 4

图 4 CIP暴露90 d内出水中SOP、NO3--N、NH4+-N、NO2--N的浓度
图 5显示的是反应器达到稳定运行之后, 单位周期内SOP、NO3--N、NH4+-N、NO2--N的浓度变化情况.从图中可以看出, 加入CIP后好氧阶段磷的吸收过程被抑制, 在厌氧阶段, CIP暴露浓度分别为0、0.05、0.5和5 mg · L-1的反应器中, 各反应中磷的释放量分别为10.15、12.22、13.1和11.95 mg · L-1(图 5a), 与空白组相对照, 说明CIP暴露对厌氧阶段SOP释放没有影响.然而, CIP对好氧阶段SOP吸收有一定的抑制作用, 随着CIP浓度由0 mg · L-1升至5 mg · L-1, 出水中SOP浓度由0.49 mg · L-1升至2.44 mg · L-1.由图 4b和图 5a可以看出, CIP的加入对NO3--N无明显影响.此外, 由图 4c和图 5b可以看出, NH4+-N的浓度也并未受到明显影响.但CIP的加入导致出水中NO2--N的浓度大幅增加.图 4d显示, 与空白组出水中NO2--N浓度(0.34 mg · L-1)相对照, 加入CIP浓度分别为0.5和5 mg · L-1时, 出水中NO2--N浓度分别增至为2.2和6.1 mg · L-1.同样在一个周期内, 缺氧阶段随着CIP浓度的提高, 出水中NO2--N的浓度分别为4.41、0.50、0.64和2.86 mg · L-1, 说明CIP的加入抑制了NO2--N向N2的转变过程, 导致出水中NO2--N浓度随CIP浓度的增高而增高.实验结果表明, CIP的加入对硝化过程无显著影响, 但随着运行周期的加长会抑制反硝化过程.
图 5
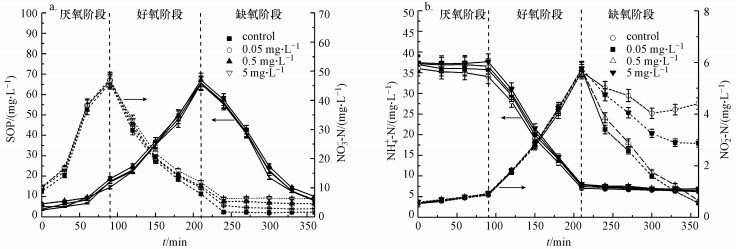
图 5长期暴露情况下单位周期内SOP、NO3--N、NH4+-N、NO2--N的浓度变化情况
PHA及糖原质的转化与生物脱氮除磷效率有密切关系(Golet et al., 2003;Gonzalez-Pleiter et al., 2013).单位周期内短期/长期PHA和糖原质的变化情况如图 6所示.在厌氧状态下, 聚磷菌吸收污水中易降解的COD(如VFA), 同化成胞内碳能源存贮物PHB或PHV等.在好氧或缺氧条件下, 聚磷菌氧化代谢胞内贮存物PHB或PHV等, 产生能量用于磷酸盐的吸收、氨氮的硝化和糖原质的补给(Wright et al., 2005), 以及反硝化脱氮等.糖原质是微生物体内除PHA外的另外一种内碳源, 其在厌氧期分解, 用于合成PHA.
短期CIP暴露对生物脱氮除磷无明显影响(图 6a).长期CIP暴露实验中, CIP的加入导致糖原质的补充及PHA的转化过程受到抑制, 并且随着CIP浓度的升高, 抑制作用逐渐加强(图 6b).进一步研究表明, CIP能直接作用于细菌的遗传物质核酸, 抑制细菌的旋转酶, 破坏遗传物质核酸的拓扑结构从而影响细菌的代谢和增殖(Wolfson et al., 1985).
图 6
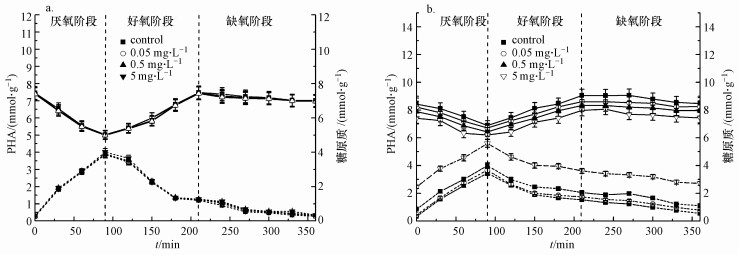
图 6短期(a)、长期(b)CIP暴露下PHA和糖原的转化情况(虚线代表PHA的浓度, 实线代表糖原质的浓度)
厌氧阶段主要是PHA的合成和糖原的转化.空白组PHA的合成量为3.45 mmol · g-1(以每g VSS中的C量(mmol)计, 下同), 糖原质的量为6.89 mmol · g-1(以每g VSS中的C量(mmol)计, 下同).而在CIP浓度分别为0.05、0.5和5 mg · L-1时, PHA的合成量分别为3.67、3.59和5.99 mmol · g-1, 糖原质的量分别为6.71、6.42、6.21 mmol · g-1.PHA的转化随着CIP浓度的增高, 抑制作用逐渐增强.好氧阶段空白组糖原质积累量为9.05 mmol · g-1, 而CIP存在时积累量分别为8.61、8.33和7.97 mmol · g-1, 可见糖原质的积累随CIP浓度的增高而降低.缺氧阶段之后, 空白组中PHA的平均值为0.55 mmol · g-1, 糖原质的平均值分别为8.47 mmol · g-1.而在CIP浓度分别为0.05、0.5和5 mg · L-1时, PHA的平均值分别为0.79、1.11和2.71 mmol · g-1, 糖原质的平均值为8.25、7.96和7.45 mmol · g-1.PHA的转化及糖原质的积累过程受到抑制, 将导致磷的吸收、硝化及反硝化过程能量不足, 最终导致脱氮除磷效率降低.
污水生物脱氮处理过程中氮的转化主要包括氨化、硝化和反硝化作用, 最终转变为氮气而被去除.而磷的去除是利用聚磷微生物, 它们具有厌氧释磷及好氧(或缺氧)超量吸磷的特性, 使好氧或缺氧段中混合液磷的浓度大幅降低, 最终通过排放含有大量富磷污泥而达到从污水中除磷的目的.这一系列的生物过程涉及众多的生物酶, 其中与生物脱氮相关的酶主要有AMO、NAR和NIR(Wang et al., 2013a;2013b;2014;Chen et al., 2014a;2014b), 而与磷的去除的相关的关键性酶主要有PPX和PPK(Tsai et al., 2013;Chen et al., 2012).因此, 为了更深入地研究CIP对脱氮除磷的影响, 本文对这些酶的活性进行了探究.
CIP浓度变化对生物脱氮相关酶NAR无明显影响, 对AMO有轻微的抑制作用, 但对NIR有显著抑制作用, 且随CIP浓度升高抑制作用逐渐加强.CIP浓度分别为0.05、0.5和5 mg · L-1时, NIR活性分别降至94.55%、80.1%和58.2%(图 7a).与生物除磷相关的酶里, 可以看出CIP浓度变化对PPK影响较为明显, 当CIP浓度为5 mg · L-1时, PPK酶活降至75%.以上实验结果均与之前观测到的生物脱氮除磷效果一致.
图 7
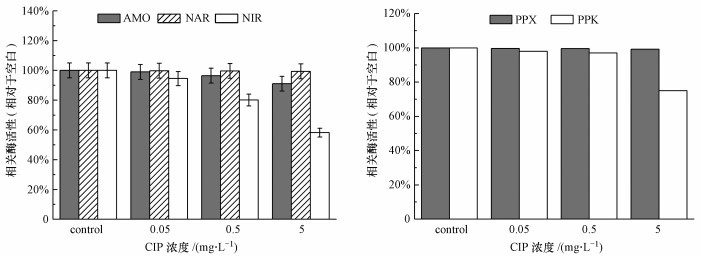
图 7活性污泥在不同CIP浓度下长期暴露后相关酶活性
4 结论(Conclusions)
1) 当CIP的浓度分别为0.003、0.03和0.3 mg · L-1时, CIP去除率大约为90%左右, 但当CIP浓度增至3和6 mg · L-1时, CIP去除率分别下降到68.5%和29.6%.通过吸附降解实验得出CIP的主要去除途径为生物吸附.
2) CIP短期/长期暴露对污泥活性及污泥生物细胞完整性无显著影响, 但长期暴露会显著提高活性污泥沉降性能.
3) 通过CIP对生物脱氮除磷的影响实验得出, 活性污泥短期暴露在CIP环境中, 对废水生物脱氮除磷无明显影响.长期运行过程中, 当CIP浓度为0.05 mg · L-1时, TP、TN的去除效率降为95.8%±0.9%、94.6%±0.8%, 与空白组相当.继续增加CIP浓度至0.5和5 mg · L-1时, TP、TN的去除效率分别下降为89.1%±0.6%、87.9%±0.4%和74.3%±0.7%、70.2%±0.6%.长期暴露会降低氮和磷的去除效率, 并且随着CIP浓度的升高, 抑制作用逐渐增强.
4) 长期CIP暴露实验中, 随着CIP浓度的升高, 单位周期内糖原质的补充及PHA的转化过程受到抑制, 导致细胞生长, 以及磷的吸收、硝化及反硝化过程能量供给不足, 并且抑制了NIR与PPK的活性, 从而导致脱氮除磷效率降低.(来源:环境科学学报 作者:邹高龙)


