随着工业技术的进步,印染废水已成为水污染现象中不可忽视的重要污染源。据报道,由于印染行业中不完善的处理和清洗技术,大概有10%~20%的染料从生产的剩余液体中排出。这些染料不仅严重影响水质,表现出颜色的变化,并且抑制阳光进入水体从而降低了水中生物的光合作用,许多染料是有毒的,而且其中一部分具有致癌和致突变性。因此,去除水中染料类污染物对保护环境具有十分重要的意义。
现已有很多物理、化学和生物方法用于处理印染废水中的染料,包括吸附法、混凝沉淀法、好氧和厌氧微生物降解法。常青等建立了一种超声辅助共沉淀的方法制备了磁性Fe3O4/氧化石墨烯(Fe3O4/GO)纳米粒子,该磁性纳米粒子可以吸附染料废水中的亚甲基蓝,在313 K时, Fe3O4/GO的饱和吸附量为196.5 mg·g-1,而且吸附材料有磁性,方便回收,是一种优良的吸附染料废水的材料;近年来膜分离技术日渐成熟,SACHDEVA等[8]用黏土做支撑材料,在500 ℃下碳化聚乙烯乙二醇和可溶性酚醛树脂的混合物得到了一种多孔的纳米复合碳膜,分离染料废水中的罗丹明B的百分比达到90%~100%,但是此方法中的复合碳膜的膜孔容易堵塞,碳膜本身难再生,而且反应需要控制pH和压力,条件苛刻;另外,以绿色氧化剂H2O2为·OH来源的高级氧化技术也受到广泛关注,WANG等采用超声法制备纳米Fe3O4,在pH 3~9内,活化H2O2产生·OH,降解染料废水中的罗丹明B,反应1 h,去除率高达90%以上;现也有利用还原法降解染料的方法。KHAN等制备了一种Au@TiO2的纳米复合材料,在NaBH4的还原体系中能够有效地催化还原亚甲基蓝和甲基橙,但是催化剂的制备过程复杂,而且金银价格昂贵,资源稀缺,成本较高,因此实际应用中受到一定限制;目前也有很多高效的非贵金属催化剂,刘双柳等以铜的有机金属框架为铜源前驱物,酚醛树脂为碳源,合成了多孔碳层制成的Cu/Cu2O/C复合材料,将其作为催化剂用于水中各种染料类污染物的脱色,发现对亚甲基蓝、硝基苯和罗丹明B具有很好的催化活性,但是催化剂的制备过程复杂,实际应用中催化剂难以回收。
现有的处理印染废水中染料的方法具有降解条件苛刻、制备过程复杂、价格昂贵、周期长、循环再生能力差等问题,因此,有必要开发高效而操作简便的处理方法。本文采用浸渍的方法在棉布上通过还原的方法制备纳米铜膜,制备方法简单。采用制备的纳米铜膜催化硼氢化钠,可快速褪色染料,该方法具有条件温和、高效和循环性好的优点,而且适用于多种染料的脱色。
1 材料和方法
1.1 试剂和仪器
一水乙酸铜(Cu(CH3COO)2·H2O)、硼氢化钠、85%水合肼均来自于国药化学试剂。所有药品都是分析纯级别,用时无须进一步纯化。实验过程中所用的水为超纯水,电导率为18.2 MΩ·cm-1。
X射线衍射仪(D8 ADVANCE型,德国布鲁克公司,射线源为CuKα靶射线,石墨单色器滤波,2θ为10°~80°),扫描电镜(Hitachi S-4800型,日立公司),紫外可见光谱仪(EVOLVTION 201型,Thermo scientific)。
1.2 铜膜的制备
称取3.125 0 g(Cu(CH3COO)2·H2O)(15.7 mmol)于烧杯中,并加入290 mL水,逐滴加入10 mL 85%的N2H4·H2O,将尺寸为4 cm×6 cm的棉布浸没在溶液中,12 h后取出,分别用超纯水和无水乙醇洗涤3次,60 ℃真空干燥2 h,得到样品铜膜,铜膜上负载纳米铜的质量约为0.304 2 g。
1.3 催化脱色实验
利用NaBH4做还原剂,分别考察了铜膜对甲基蓝、亚甲基蓝、结晶紫、刚果红、金橙Ⅱ、碱性嫩黄素、甲基橙和罗丹明B等8种染料的催化性能,其中阳离子染料有甲基蓝、亚甲基蓝、结晶紫和罗丹明B,阴离子染料有刚果红、橙黄Ⅱ、碱性嫩黄素和甲基橙。反应在250 mL反应器中进行,用双面胶将铜膜一侧与烧杯壁粘连,加入200 mL 20 μmol·L-1目标污染物,进行磁力搅拌,测量目标污染物的初始吸光值,加入2 mL 0.5 mol·L-1NaBH4,反应即开始,每隔一定时间测定一次吸光值。催化剂浓度为1.521 g·L-1。
对照实验反应液中分别只加入NaBH4和纳米铜膜,再分别用铜丝和铜片取代铜膜做染料的脱色反应,以此验证纳米铜膜的催化效果。
1.4 铜膜吸附实验
为了进一步说明各种染料降解速度快慢的问题,利用铜膜进行了吸附实验。实验在250 mL反应器中进行,用双面胶将铜膜一侧与烧杯壁粘连,实验溶液为200 mL的20 μmol·L-1目标污染物溶液。首先,测定实验溶液的初始吸光值。然后,将目标污染物加入到烧杯中,进行磁力搅拌,吸附0.5 h以后再测溶液吸光值,得到铜膜吸附染料的吸附率。
1.5 污染物的定量分析
紫外可见分光光度法分析:污染物的浓度由紫外可见分光光度计测得。
2 结果与讨论
2.1 物相和形貌的表征
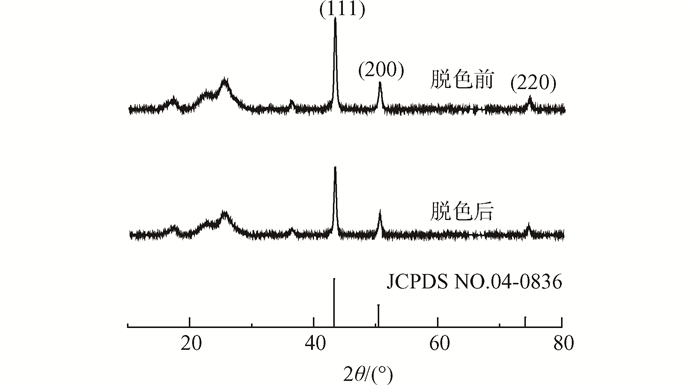
用X射线衍射仪制备的铜膜表面的纳米铜的晶体结构,结果如图 1所示,反应之前铜膜上纳米铜的谱图上出现了3个明显的衍射峰,分别在2θ为43.3°、50.4°和74.1°,依次对应于面心立方结构金属铜的(111)、(200)以及(220)晶面的特征衍射峰,其相对强度和晶面间距与JCPDS标准卡NO.04-0836给出的数据基本一致,说明纳米铜被成功制备。用于脱色反应之后的铜膜在相同的位置出现3个衍射峰,说明反应后铜膜上的纳米铜未发生变化,稳定性好。图 2是制备的纳米铜膜的照片以及SEM照片,由图 1(a)和(b)可见制备的纳米铜膜表面成深色,由图 1(c)和(d)可见纳米铜粒子近似成球形,平均粒径为700~800 nm。
图1 脱色前后铜膜上纳米铜的XRD图谱
图2 纳米铜膜的照片和扫描电镜图
2.2 染料废水的催化还原脱色
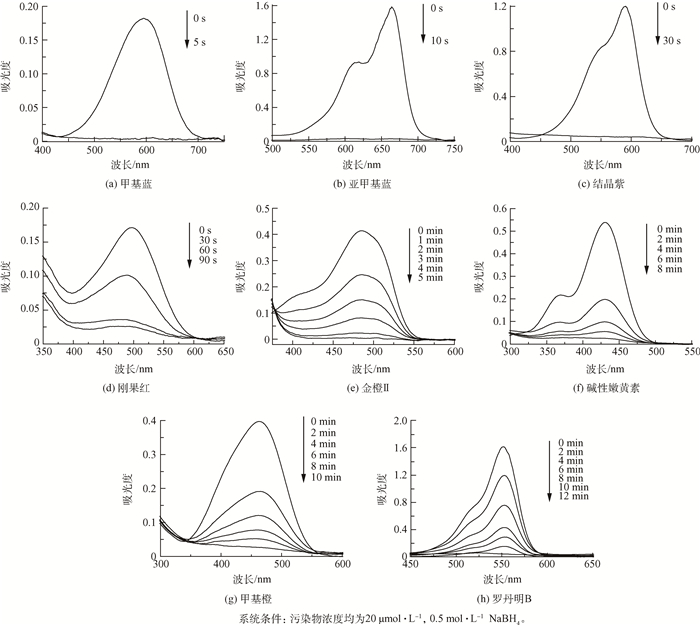
利用纳米铜膜做催化剂,催化还原甲基蓝、亚甲基蓝、结晶紫、刚果红、金橙Ⅱ、碱性嫩黄素、甲基橙和罗丹明B的过程和结果如图 3所示,可以看出200 mL 20 μmol·L-1的甲基蓝(图 3(a))、亚甲基蓝(图 3(b))和结晶紫(图 3(c))在各自最大吸收波长处的特征吸收峰随反应时间的变化快速降低,分别只需5 s、10 s和30 s,可完全褪色;相同浓度的刚果红(图 3(d))和金橙Ⅱ(图 3(e))也只需要1.5 min和5 min即可完全褪色;相对以上染料褪色速度较慢的碱性嫩黄素(图 3(f))、甲基橙(图 3(g))和罗丹明B(图 3(h)),分别需要8、10和12 min即可完全褪色。
图3 脱色过程中8种目标污染物的紫外吸收光谱图
为了进一步量化催化还原反应的速率,本论文使用一级动力学方程来模拟各染料的脱色过程,一级动力学方程如下:
ln(c/c 0 )=ln(A/A 0 )=−kt ln(c/c0)=ln(A/A0)=−kt
式中:c为染料在t时的浓度;c0为时间为0时染料的浓度;A为染料在t时的吸光值;A0为时间为0时染料的吸光值;k为反应速率常数,min-1;t为反应时间,min。
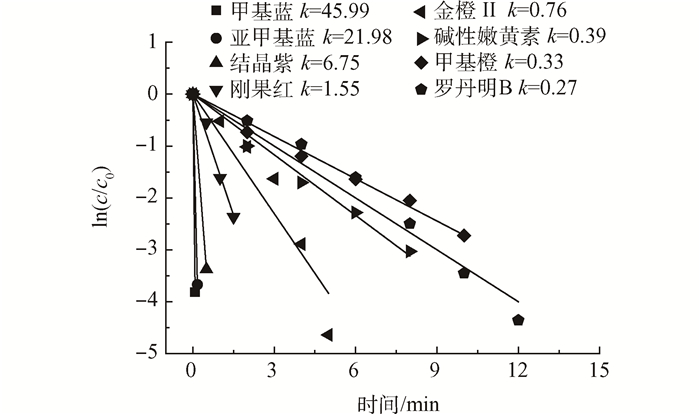
从图 4中也可以看出各种染料脱色过程中的反应速率常数中甲基蓝的最大,达到了45.99 min-1,其次是亚甲基蓝,k值为21.98 min-1,然后依次是结晶紫、刚果红、金橙Ⅱ、碱性嫩黄素、甲基橙和罗丹明B。
图4 时间对8种污染物ln(c/c0)的影响
这说明制备的纳米铜膜对以上8种染料都具有很明显的脱色效果,而且明显加快了染料的脱色速度,进一步拓宽了铜膜的应用范围。
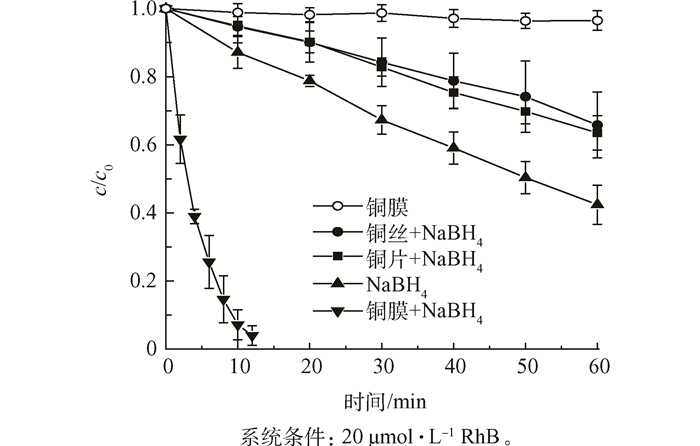
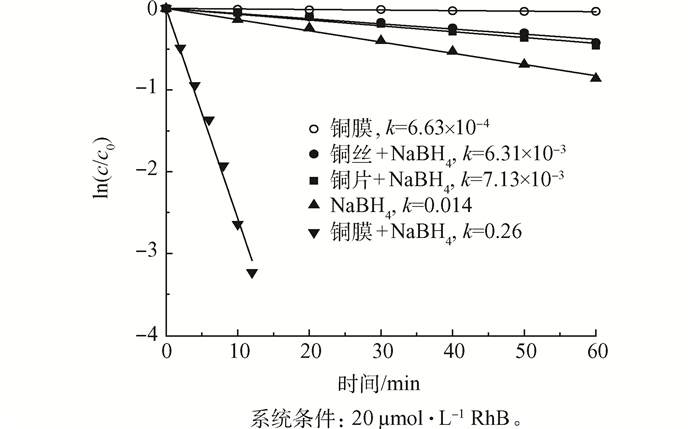
为了证明是铜膜在起作用,本研究以罗丹明B为例,设置不同体系下罗丹明B的脱色效果,如图 5所示。在对比实验中,当向20 μmol·L-1的罗丹明B反应液中只加NaBH4时,罗丹明B经过1 h的还原脱色程度只能达到58%;而当反应液中不加入NaBH4,只放入铜膜时,此时反应中没有还原剂,体系内不发生还原反应,罗丹明B的浓度几乎不发生变化;当相还原体系加入尺寸为4 cm×6 cm的铜片后,罗丹明B经过1 h的反应只能除去34%;加入洁净的铜丝后的效果与加入铜片后的脱色效果相似,1 h后罗丹明B的脱色效率为37%;而使用铜膜的催化还原体系只需12 min就可以除去98%的罗丹明B,这说明在整个染料的脱色实验中是本研究制备的铜膜在起作用,而且催化效率很高。
图5 不同体系下罗丹明B溶液的降解效果图
不同体系下罗丹明B溶液的ln(c/c0)随时间变化情况如图 6所示,可以看出在不加入催化剂和加入纳米铜膜进行催化的条件下,罗丹明B的褪色效率差别极大,不加入催化剂只用NaBH4还原的反应速率常数为0.013 7 min-1,只加催化剂不加NaBH4的反应速率常数仅为6.64×10-4 min-1,而与纳米铜膜进行对照实验的加入铜片和铜丝的反应速率常数分别为7.13×10-3 min-1和6.31×10-3 min-1,使用纳米铜膜做催化剂的反应常数为0.257 min-1,明显高于其他体系。经纳米铜膜的催化还原后,罗丹明B溶液的色度褪去明显,有利于染料废水的后续处理。具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
图6 时间对不同体系罗丹明B溶液ln(c/c0)的影响
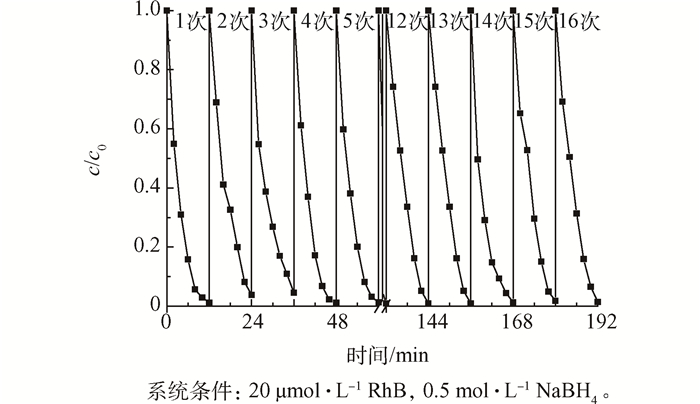
稳定性和循环性是衡量一种催化剂催化性能的重要指标。在本研究中,以罗丹明B为例,在每一次催化还原实验后取出铜膜,用无水乙醇和超纯水进行清洗,并用到下一次循环中,如图 7所示,催化剂反复利用16次以后,罗丹明B的脱色效率仍然在98%以上,说明制备的铜膜结构稳定,可循环性好,实际应用价值高。
图7 催化剂循环利用效率
2.3 铜膜催化染料脱色的机理
在NaBH4做还原剂的情况下,利用铜膜催化还原以上几种染料和污染物的机理可以这样解释:根据Langmuir-Hinshelwood模型,开始时溶液中的BH4-与染料分子被吸附在铜膜表面,BH4-向纳米铜提供电子,在纳米铜粒子周围形成一层带负电的电子层[12],随后,纳米铜粒子将这些电子转移到污染物分子上,用于引发在铜膜表面发生的还原反应[13];而且在此反应体系中,NaBH4还会生成活性氢,直接对目标污染物进行还原[14-15]。
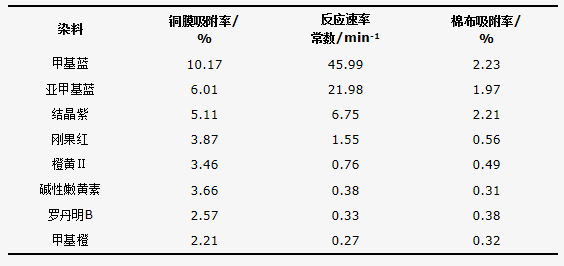
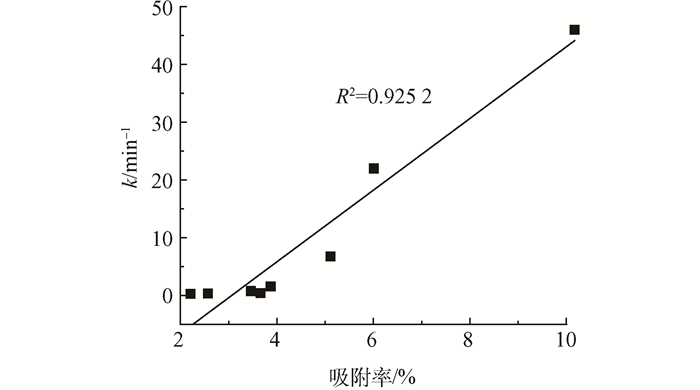
通过实验现象可以发现甲基蓝的脱色速度是最快的,造成这个现象的主要原因是纳米铜膜对这几种染料的吸附能力不同,由表 1可以看出棉布对每种染料均有吸附,但吸附效果较铜膜的吸附效果来说相对较弱,说明吸附作用主要来自于铜膜对染料的吸附作用。其中铜膜对甲基蓝的吸附效果最佳,吸附率达到10.17%,也是由于甲基蓝分子对铜膜表面的高吸附度显著增强电子转移效率和与活性氢的接触机会,所以甲基蓝的脱色速度是最快的。其次将铜膜吸附染料的吸附率结果与染料脱色过程的反应速率常数进行线性拟合,见图 8,其线性关系明显,R2=0.925 2,说明铜膜表面对染料的吸附情况决定了脱色反应的快慢。
表1 8种染料脱色的反应速率常数和在纳米铜膜及棉布表面吸附率
3 结语
以Cu(CH3COO)2·H2O为铜源前驱物,水合肼为还原剂,通过浸渍的方法在棉布上负载纳米铜,成功制备了纳米铜膜。这种纳米铜膜具有良好的导电性,能够快速传导电子,加快还原反应的进程。采用制备的纳米铜膜催化NaBH4,可快速褪色甲基蓝、亚甲基蓝、结晶紫、刚果红、金橙Ⅱ、碱性嫩黄素、甲基橙和罗丹明B等8种染料。分别在5 s、10 s、30 s、1.5 min、5 min、8 min、10 min和12 min完全褪色,表现出良好的催化效果。而且具有制备方法简单、催化条件温和、反应快速高效和循环性能好等优点,达到了高效、节能、环保的目的,在污染控制方面具有潜在的应用价值。(来源:环境工程学报 作者:曹金)