近年来, 日益严重的水体富营养化问题已成为全球性的环境问题.水体的富营养化会导致水体中藻类的大量生长繁殖, 不仅会破坏水体的生态平衡, 而且会严重地干扰水处理过程.例如, 原水中的大量藻类会堵塞滤床、恶化水质、堵塞或腐蚀管道、增大混凝剂投加量、产生嗅味、藻毒素以及消毒副产物的前驱物等.
目前国内大多数水厂仍然采用传统的混凝-沉淀-过滤-消毒工艺, 然而常规的净水工艺主要以去除水中颗粒物为主, 通常不能有效净化含藻水体.以超滤为核心的组合工艺是代替传统工艺的最佳选择之一, 超滤膜技术能有效去除水体中的悬浮颗粒病原体以及内分泌干扰物等.然而, 藻类引起严重的膜污染问题是限制超滤技术在高藻水处理应用中最大障碍.预处理技术被认为是降低膜污染的有效途径, 常用的预处理技术有混凝预处理、氧化预处理、吸附预处理等.预氧化过程可能使藻细胞破碎, 释放藻类胞内有机物, 导致饮用水的生物安全性降低以及消毒副产物的增加, 威胁人类健康.混凝预处理技术操作简便、成本低廉、绿色环保、并且能有效提高出水水质, 因此, 混凝作为超滤过程的预处理技术得到了越来越多的应用, 并且混凝效率直接影响着出水水质, 进而影响超滤过程.有研究表明, 混凝剂的Al形态对于混凝-超滤过程具有重要影响, Al13可产生粒径较大的絮体, 且形成的絮体具有较大的强度与密实度, 膜通量达到最优条件时, Al13投加量较聚合氯化铝(PACl)有明显的下降.并且藻类胞外有机物(EOM)种类对混凝-超滤过程同样有着重要影响, Qu等的研究表明EOM的主要组成是高分子量以及亲水性的有机物, 包括蛋白质、多糖以及腐殖酸类物质. EOM可引起严重的膜污染, 疏水性有机物会吸附在膜表面形成不可逆污染, 同时滤饼层含有的亲水性有机物可导致快速的膜污染. Zhou等的研究表明不可逆污染随pH值的下降而上升, Ca2+的存在可导致严重的通量下降及不可逆污染.
综上所述, 目前关于藻类有机物种类和混凝剂种类对混凝-超滤过程的研究已经较为充分, 但是对于不同形态藻细胞对混凝-超滤过程的影响机制的阐述并不充分.因此, 本研究以实验室配置的高藻水为实验原水, 以3种不同形态藻细胞为处理对象, 分析了不同的混凝剂对3种形态藻细胞的去除效率以及出水对超滤膜污染的机制, 以期为水厂在藻类暴发阶段保证优质的饮用水供应提供指导.
1 材料与方法1.1 主要实验仪器
浊度仪(2100N, Turbidimeter, HACH, USA); pH计(MP220, pH Meter, Mettler-Toledo, Switzerland); UV-8500紫外/可见分光光度计(上海天美公司); 马尔文激光粒度分析仪(Laser Particle Analyzer, Mastersizer 2000, Malvern, UK); MY3000-6G智能型混凝搅拌仪(武汉梅宇有限公司); 扫描电子显微镜(HITACHI SU8020 FE-SEM, Japan); 高速冷冻离心机(Aantij26XP, Beckman Coulter. Inc. USA).
1.2 藻种培养及水样配置1.2.1 藻种培养
铜绿微囊藻(蓝藻)、小球藻(绿藻)、小环藻(硅藻)均购置于中国科学院武汉水生生物研究所.铜绿微囊藻和小球藻采用BG11培养基进行培养, 小环藻采用CSI培养基进行培养, 无菌条件下接种至玻璃锥形瓶中, 放在人工气候箱中培养, 培养条件:温度25℃±1℃, 光照强度2 000 lx, 光暗比(L:D)=12h:12h.定期进行细胞计数, 绘制藻类生长曲线, 待藻种达到稳定期后用于实验.
1.2.2 藻细胞的分离
为了更好地保持藻细胞的完整性以及高效分离藻的胞外有机物, 选择分离方法为:将原藻液置于高速冷冻离心机中, 设置离心温度4℃, 4 000 r·min-1, 时间5 min, 待离心完成后上清液即为藻类胞外溶解性有机物; 使用0.6% NaCl溶液将离心管底藻细胞重新溶解, 40℃水浴加热20 min再次离心, 设置离心温度4℃, 离心力10 000 r·min-1, 时间15 min, 待离心完成后上清液即为藻类胞外黏附性有机物; 再次使用0.6% NaCl溶液将离心管底藻细胞重新溶解即可得到实验所需裸藻细胞.
1.2.3 水样配置
藻类的藻细胞密度与悬浮液在680 nm处的吸光度具有良好的线性关系, 因此本研究以含藻水在680 nm处的吸光度值作为藻细胞密度的度量标准.为方便藻细胞之间对比, 3种藻细胞均用去离子水稀释至680处的吸光度值为0.300, 并加入5.0 mmol·L-1 NaNO3和4.0 mmol·L-1 NaHCO3提供离子强度和碱度, 使用盐酸(0.1 mmol·L-1)和氢氧化钠(0.1 mmol·L-1)溶液调节pH=8.5.
1.3 混凝剂的选择
本实验选用Al2(SO4)3、Al13以及Al30这3种铝系混凝剂.采用Ferron络合比色法对混凝剂中铝形态分布进行测定, Ferron逐时络合比色法将聚合铝中铝的形态分为:单体态Ala(反应时间<1.0 min)、Alb(反应时间在1~120 min)、Alc(不反应).本实验所用混凝剂的Ferron表征结果见表 1.
表 1 实验所用混凝剂的Al形态分布/%
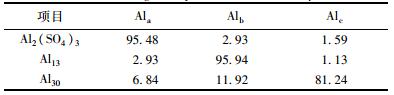
由表 1可看出, 实验所用混凝剂有不同的铝形态分布, 其中硫酸铝主要成分为Ala, Al13主要成分主要为Alb, Al30的主要成分主要为Alc.
1.4 实验方法1.4.1 混凝实验
使用六联混凝搅拌仪进行烧杯实验, 加入混凝剂后以200 r·min-1快速搅拌90 s, 40 r·min-1慢速搅拌10 min, 沉淀30 min后于上清液下2.0 cm处取样测量浊度及藻细胞吸光度值, 计算浊度以及藻细胞的去除率.
1.4.2 超滤实验
在3种藻体系中, 分别选择在3种混凝剂的最佳投加量下进行超滤实验, 并且选择在混凝结束后不经沉淀直接进行超滤实验.超滤杯购自Millipore, 型号为Amicon 8400.平板超滤膜(100×103)购自安德膜科技有限公司(北京), 材质为聚偏氟乙烯(PVDF).超滤实验过程中, 固定压力为0.1 MPa, 超滤时间为1 800 s.超滤过程结束后, 将PVDF膜自然干燥, 使用扫描电子显微镜对膜表面情况进行分析.
1.4.3 絮体特征
为了更好地了解每种混凝剂的作用机制, 本实验使用马尔文激光粒度仪对絮体形成过程进行在线监测, 以D50(μm)代表絮体的平均粒径.并且针对已形成的絮体增大搅拌强度至200 r·min-1 (持续5.0 min), 随后再次以40 r·min-1转速(持续10 min)使絮体再生, 考察絮体的强度因子和恢复因子.
2 结果与讨论2.1 藻细胞扫描电镜图
为了更好地考察藻细胞形态对于混凝过程的影响, 对于3种藻细胞分别进行了扫描电镜观察, 实验结果见图 1.
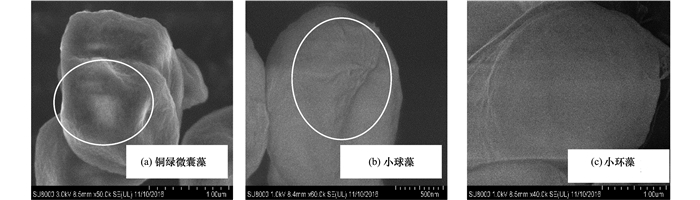
图 1 实验所选藻细胞扫描电镜形貌
实验结果表明, 铜绿微囊藻藻细胞粒径较小(700 nm左右), 且细胞表面存在一定的凹陷, 小球藻与小环藻细胞粒径较大(大于1 μm), 小球藻表面也存在凹陷.
2.2 投加量对混凝过程的影响
为了考察混凝剂投加量对藻细胞及浊度去除率的影响, 调节3种混凝剂的投加量(以Al计)从0.02~0.12 mmol·L-1, 实验结果见图 2.
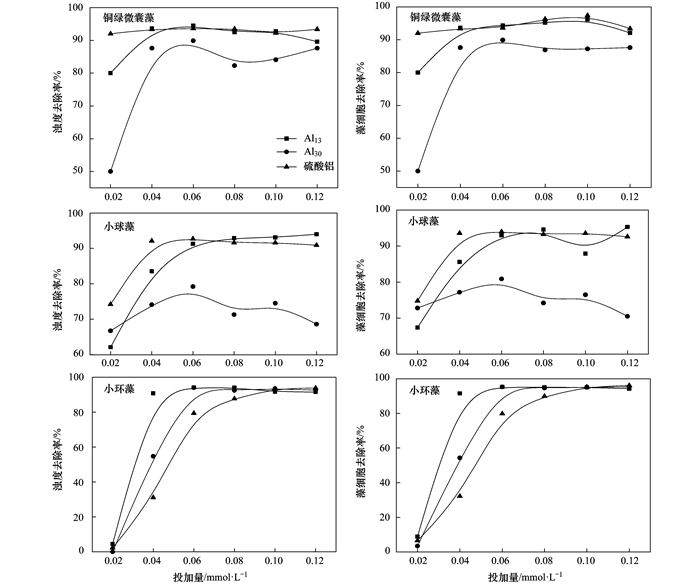
图 2 混凝剂投加量对混凝效果的影响
由图 2可以发现, 对于铜绿微囊藻和小球藻体系, Al2(SO4)3在投加量达到0.04 mmol·L-1时, 即可达到最佳的混凝效果(浊度去除率与藻细胞去除率接近90%).当Al13作混凝剂时, 投加量达到0.06 mmol·L-1才能达到相同的浊度与藻细胞去除率.当使用Al30作混凝剂时, 两种藻细胞体系的浊度以及藻细胞去除率均无法达到上述两种混凝剂的去除率(铜绿微囊藻在80%左右, 而小球藻在70%左右).分析原因在于Al13与Al30主要的作用机制是静电簇作用, 而AS的主要作用机制是电中和作用(图 3).当Al13与Al30做混凝剂时, 处于凹陷部分的Al13与Al30分子的静电簇作用减弱, 而其他能产生有效碰撞的部位仍具有较多的负电荷, 此时电中和作用占主导的AS (有效降低颗粒之间的排斥作用)可使藻细胞颗粒有效结合.而在小环藻体系中, 由于小环藻细胞表面较为光滑(图 1), Al13与Al30的静电簇作用机制可以得到有效发挥, Al13与Al30在较低投加量下可有效去除藻细胞.为方便对比, 在接下来的实验过程中选择3种混凝剂的最佳投加量进行实验.
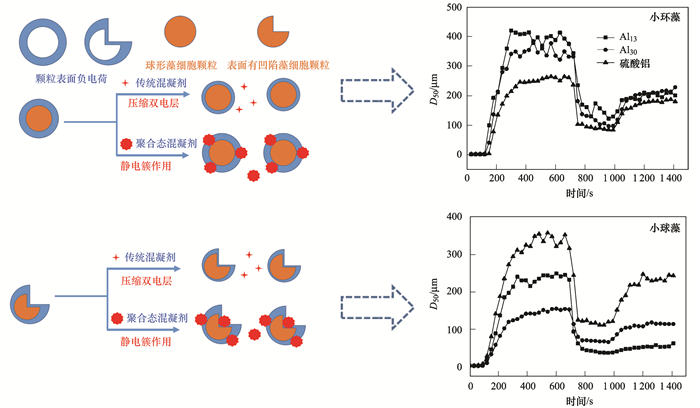
图 3 3种藻混凝过程的机制
2.3 膜比通量(J/J0)
本实验以膜比通量J/J0表示膜污染程度, 其中J/J0为初始膜通量, 膜比通量越大, 表明膜污染越轻, 不同条件下的膜比通量结果见图 4.
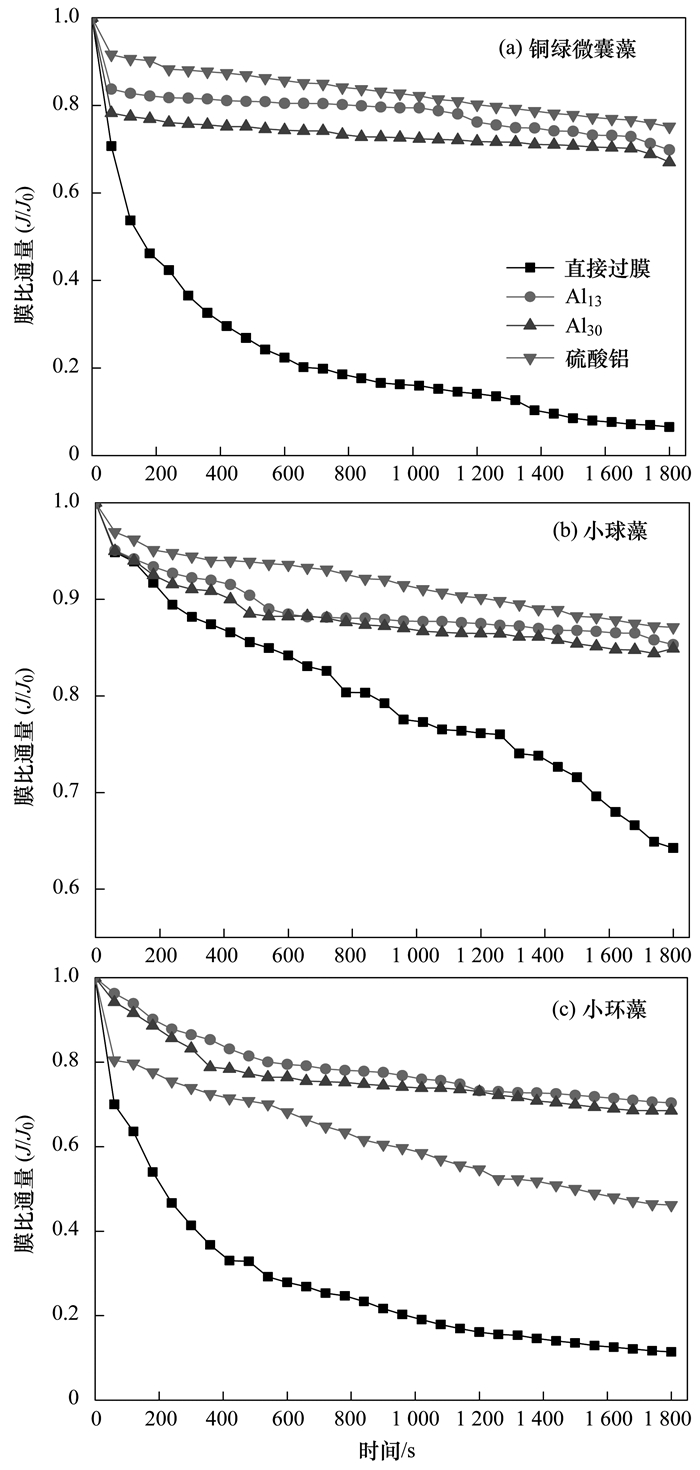
图 4 3种藻在不同混凝剂作用下引起的膜比通量
由图 4可以得出, 3种藻在不经混凝作用直接过膜时, 由于藻本身的性质, 其造成的膜污染差异较大. 1 800 s内铜绿微囊藻引起的膜比通量下降为0.065, 小球藻引起的膜比通量下降为0.643, 小环藻引起的膜比通量为0.114.由于实验本身所用的3种藻细胞粒径远大于超滤膜孔径, 所以较大的藻细胞本身并不会堵塞膜孔, 引起超滤膜污染的主要方式为藻细胞沉积层.铜绿微囊藻由于本身体积较小, 形成的沉积层较为密实, 因而膜比通量下降程度相对比较大.
另外, 3种藻细胞在经过混凝剂作用后, 在过膜时引起的膜比通量得到了明显的提升.在铜绿微囊藻体系中, 经过Al2(SO4)3、Al13和Al30这3种混凝剂作用后, 1 800 s内膜比通量分别提升至0.751、0.698和0.67.在小球藻体系中, 1 800 s内膜比通量分别提升至0.871, 0.854和0.849.在小环藻体系中, 1 800 s内膜比通量分别提升至0.462、0.704和0.685.在铜绿微囊藻和小球藻体系中, Al2(SO4)3对膜污染缓解程度大于Al13和Al30混凝剂形成的絮体, 而对于小环藻体系, Al13和Al30混凝剂形成的絮体可更有效地缓解膜污染.由于在3种藻体系中有机物已经得到了分离, 因此经混凝作用后影响膜污染的主要因素为絮体性质, 不同作用条件下絮体的特性将在2.4节中进行详细分析.
2.4 絮体性质
3种藻在不同混凝剂作用下形成的絮体的性质, 是超滤过程中膜污染的主要影响因素.因此, 考察絮体的形成、破碎和再生长过程对于了解膜污染机制, 有效控制膜污染具有重要的意义, 混凝过程中絮体粒径变化情况见图 5.
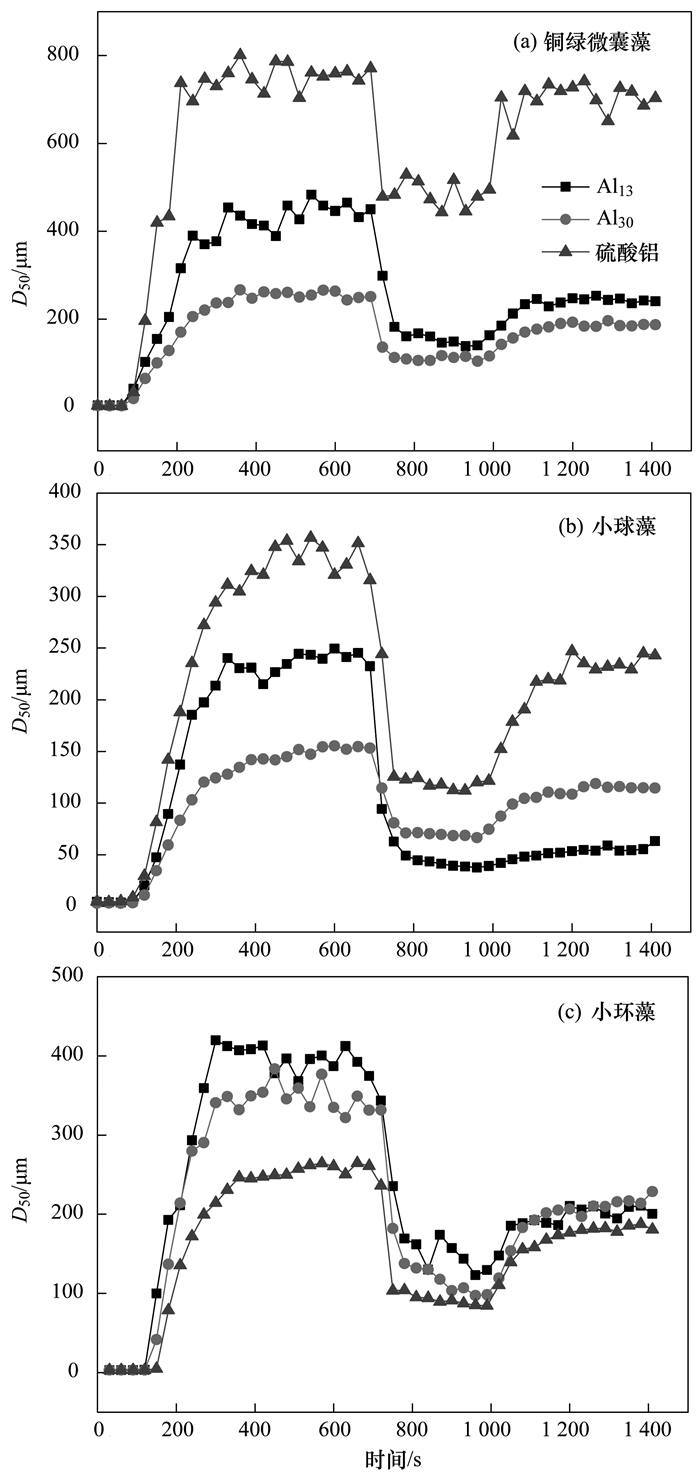
图 5 3种藻在不同混凝剂作用下形成的絮体粒径变化
由图 5可以看出, 在铜绿微囊藻和小球藻体系中, Al2(SO4)3混凝剂形成的絮体平衡时粒径分别达到了750 μm (铜绿微囊藻)和350 μm (小球藻), 而Al13和Al30混凝剂形成的絮体分别为420 μm、220 μm (铜绿微囊藻)和240 μm、150 μm (小球藻).而在小环藻体系中, 平衡时絮体粒径分别为250 μm (AS)、400 μm (Al13)和350 μm (Al30).与2.2节中的分析类似, 对于铜绿微囊藻以及小球藻体系, AS的电中和作用使得藻细胞颗粒可以更有效地接触, 快速形成肉眼可见的絮体, 而Al13与Al30的静电簇作用由于表面凹陷的存在而受到一定的影响.
不同条件下形成絮体的强度因子及恢复因子见表 2.
表 2 3种藻在不同混凝剂作用下形成的絮体的强度因子和恢复因子
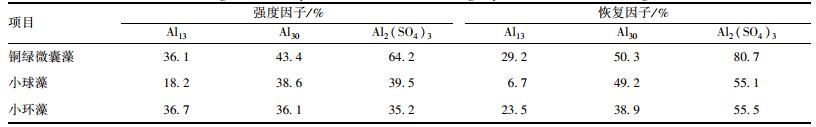
由表 2可以得出, 在铜绿微囊藻体系和小球藻体系中, Al2(SO4)3混凝剂形成的絮体强度因子达到64.2%和39.5%, 而Al13和Al30混凝剂形成的絮体强度因子为36.1%、18.2%和43.4%、38.6%.结合膜通量的实验可以发现, 在同一种藻体系中, 强度因子越大的絮体, 在超滤过程抗压力能力越强, 从而使得絮体之间越疏松, 膜表面沉积层越疏松, 膜比通量越大.而在小环藻体系中, Al13和Al30混凝剂形成絮体强度因子分别达到36.7%和36.1%, 略大于Al2(SO4)3混凝剂形成的絮体的强度因子(35.2%).另外, 对比铜绿微囊藻、小球藻和小环藻3种藻体系, Al2(SO4)3混凝剂形成絮体的恢复因子分别达到80.7%、55.1%和55.5%, 而Al13和Al30混凝剂形成的絮体恢复因子为29.2%、6.7%、23.5%和50.3%、49.2%、38.9%. Al2(SO4)3混凝剂形成的絮体相比于Al13和Al30混凝剂形成的絮体拥有更好的再生能力, 此结果与前人的结果一致, 即电中和作用所形成的絮体粒径更易在絮体恢复过程中得到恢复.
2.5 膜表面扫描电镜图
为了更好地分析膜污染的过程, 使用扫描电子显微镜对自然干燥后的膜(直接过滤藻细胞)表面进行了分析, 实验结果见图 6.

图 6 膜表面扫描电镜图(直接过滤原始藻液)
从图 6(a)可以看出, 原始PVDF膜表面膜孔明显, 在3种藻直接过膜后, 膜表面形成了藻细胞的沉积层. 图 6(c)中小球藻形成的沉积层之间缝隙比图 6(b)中铜绿微囊藻形成的沉积层缝隙和图 6(d)中小环藻形成的沉积层缝隙更为明显, 因而在3种藻不经混凝作用直接过膜时, 小球藻在1 800 s内仍有较高的膜比通量(0.643), 而此时铜绿微囊藻和小环藻直接过膜后膜比通量仅有0.065和0.114.
过滤经混凝剂处理后的藻细胞悬浮液且自然风干的膜表面的扫描电镜结果见图 7.
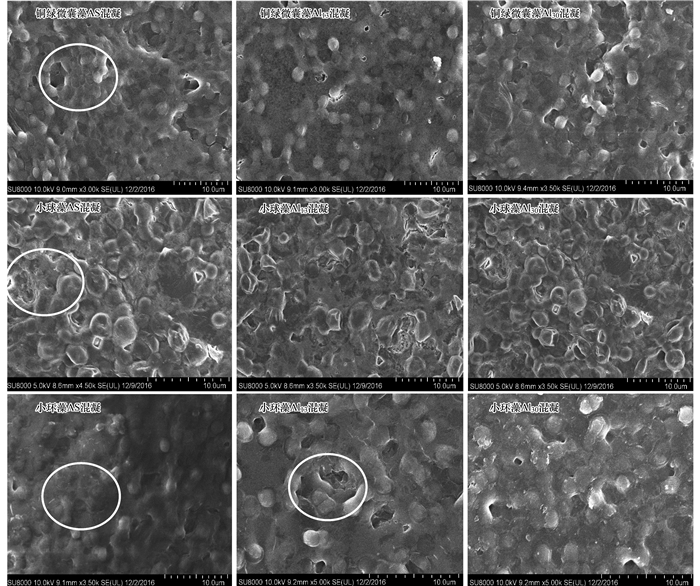
图 7 膜表面扫描电镜图——经过不同混凝剂处理
由图 7可以发现, 对于铜绿微囊藻体系, 在AS做混凝剂时可明显形成絮体, 而使用Al13与Al30做混凝剂时絮体形成不明显, 在膜表面仍然会形成致密的污染层, 导致膜通量下降较快.同样对于小球藻体系, 当使用AS做混凝剂时可以在膜表面形成比较明显的污染层, 而Al13以及Al30由于絮体形成不明显, 使得膜表面污染层较为致密, 通量下降较快.而对于小环藻体系, 当使用AS做混凝剂时, 絮体形成不明显, 造成膜比通量下降最快(1 800 s后下降为0.462).具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
3 结论
(1) 3种藻细胞具有不同的粒径与形貌, 铜绿微囊藻细胞粒径为700 nm左右, 而小球藻和小环藻的细胞粒径大于1 μm.铜绿微囊藻与小球藻的细胞表面存在一定的凹陷, 而小环藻的细胞则较为光滑.
(2) 对于表面有凹陷的藻细胞而言, Al13与Al30的静电簇作用机制由于某一部分混凝剂被吸附在凹陷处而受到影响, 而此时电中和作用占主导的AS (有效降低颗粒之间的排斥作用)可使藻细胞颗粒有效结合.
(3) 在铜绿微囊藻和小球藻体系中, AS对膜污染缓解程度大于Al13和Al30混凝剂形成的絮体, 而对于小环藻体系, Al13和Al30混凝剂形成的絮体可更有效地缓解膜污染.
(4) 在铜绿微囊藻和小球藻体系中, AS形成的絮体具有较大的强度因子, 絮体的抗压能力较强, 在超滤过程中容易形成较为疏松的滤饼层, 膜比通量较大.在小环藻体系中, Al13与Al30形成的絮体强度因子略大于AS形成的絮体, 膜比通量较大.
