1 引言
核电站在正常运行工况下,放射性废液中含有腐蚀产物(如Ag、Co、Cr、Mn、Fe)和裂变产物(如Cs、Sr、I),其中大部分核素以离子形态存在,可以通过目前核电站普遍采用的“过滤+离子交换”工艺加以去除;而110mAg、60Co、58Co等一些核素在碱性低浓度溶液中易于转化为胶体形态,或者与化学去污废液中含有的柠檬酸、草酸、EDTA及表面活性剂形成络合状态,常规的“过滤+离子交换”工艺对此类胶体形态放射性核素的去除效果有限,易引起110mAg等放射性核素排放量升高.亚稳态的110mAg主要由反应堆含银密封件和Ag-In-Cd控制棒中的109Ag通过中子活化产生,具有γ放射性,其半衰期为249 d.已有许多研究发现,110mAg易在海洋生物体内积累,并存在通过食物链进入人体的风险.因此,对放射性废液中胶体态110mAg的高效去除是目前在运核电站亟待解决的问题.
以国内某在运核电站放射性废液处理系统(TEU)为例,来水主要有工艺水、化学水和地板水3部分,其中,110mAg主要来自工艺水和化学水.现有技术存在的问题体现在:工艺水经离子交换树脂除盐床净化,其中,离子态核素基本被处理干净,但胶体态110mAg因去污系数低而穿透;化学水经蒸发器净化,由于其中含有化学去污带来的络合剂(如草酸、柠檬酸和EDTA)和多种表面活性剂,因此,在蒸发过程中出现发泡现象,110mAg易于被含有机物的蒸汽携带进入冷凝水.以上两部分出水在TER段汇集后排放,导致排出液中110mAg份额可达到57%.
对法国电力放射性废液中110mAg的形态分析结果表明,在冷却剂中同时存在离子态的Ag+和胶体态的Ag0,胶体颗粒直径为0.02~0.06 μm;此外,废液中的络合剂及表面活性剂容易与Ag形成一定颗粒度的大分子,增加Ag的溶解性.针对我国核电站中胶体态110mAg的形态至今还没有深入的分析,也尚未研发针对性技术来提高110mAg的精处理性能.
因此,本文拟通过模拟核电站水化学环境,分别研究工艺水和化学水中110mAg的存在形态,以柠檬酸为例重点研究络合剂对110mAg形态的影响,并选用一种分子筛吸附剂与两种目前核电站常用的树脂材料,对比研究不同形态110mAg的吸附性能,探索提高110mAg去除率的工艺途径.
2 材料与方法
2.1 试剂
双氧水(H2O2,AR,质量分数30%)、硝酸银(AgNO3,AR)、柠檬酸(C6H8O7,AR)、水合肼(N2H4·H2O,AR)、硝酸(HNO3,GR),以上试剂均购自北京国药试剂厂;去离子水(H2O)为自制.
选用的两种树脂分别为漂莱特树脂NRW3560(颗粒直径1 mm)、陶氏树脂IRN170(颗粒直径1 mm);分子筛13X颗粒直径3 mm.
2.2 模拟放射性废液环境下银胶体的制备
110mAg胶体主要存在于核电站工艺水和化学水中.工艺水源自核电站不能复用的一回路冷却剂,在正常运行过程冷却剂始终处于辐照场中,为了抑制溶解氧引起的腐蚀作用,冷却剂中需要加入水合肼(水合联氨),因此,冷却剂具有还原性,柠檬酸可与110mAg形成110mAg0/柠檬酸纳米金属复合物;而化学水中含有多种化学去污过程中引入的络合剂和表面活性剂,柠檬酸可与110mAg形成离子态络合物.本文以水合肼为还原剂,以柠檬酸为代表性络合剂,以钴源为辐照场,在模拟低放废液水化学环境下,分别采用化学还原法和60Co辐照法制备银胶体,以便对110mAg胶体的化学形态进行深入分析. 具体制备方法如下.
化学还原法制备Ag-柠檬酸胶体(A)和单独Ag胶体(B):分别配制银浓度为1 g·L-1的硝酸银溶液、1.7812 g·L-1的柠檬酸溶液、0.5460 g·L-1的水合肼溶液. Ag-柠檬酸胶体A制备中,取1 mL硝酸银溶液、1 mL柠檬酸溶液和40 mL去离子水于50 mL的离心管,置于30 ℃、150 r·min-1的恒温振荡摇床中混合20 min,加入5 mL水合肼溶液,并将溶液总体积定容为50 mL,置于恒温振荡摇床中继续反应2 h.单独Ag胶体B的制备过程类似,区别在于不加入檬酸溶液.
辐照还原法制备Ag-柠檬酸胶体(C)和单独Ag胶体(D):第一组10支石英玻璃试管中分别加入0.3 mL硝酸银溶液、0.3 mL柠檬酸溶液和14.4 mL去离子水;第二组10支石英玻璃试管中分别加入0.3 mL硝酸银溶液和14.7 mL去离子水,将两组试管置于剂量率为30 Gy·min-1的 60Co辐照场实验台架上,每隔30 min在两组中各取出1支试管. 用紫外吸收光谱测定所得样品中Ag纳米颗粒吸收峰,将第一组和第二组中峰值最高的样品命名为Ag-柠檬酸胶体C和单独Ag胶体D.
2.3 吸附性能测试
采用静态批量实验方法获得材料对不同形态Ag物种的吸附分配系数(Kd),藉此对比不同形态Ag物种的吸附去除性能.在批量实验中,将10 mg吸附剂加入到装有40 mL测试溶液的聚四氟乙烯离心管中(固液比为250 mg·L-1),吸附反应在30 ℃下持续振荡进行2 d. 吸附平衡后抽取一定量的混合液,采用0.15 μm的一次性微孔滤膜过滤去除悬浮物质,所得清液和初始溶液一起采用等离子体质谱(ICP-MAS)检测Ag+浓度.
材料对Ag+的吸附性能可以用吸附百分比(A)和分配系数(Kd,mL·g-1)来表征,计算公式如下:
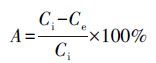
(1)
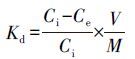
(2)
式中,Ci和Ce分别为溶液中初始离子浓度和平衡浓度(mg·L-1),V为吸附质溶液的体积(mL),m为吸附剂的质量(mg).
2.4 高级氧化实验
银胶体的高级氧化实验在自制紫外线反应器中进行,聚四氟乙烯反应管容积为350 mL,石英紫外线灯管长19 cm,功率10 W,波长254 nm,使用电磁搅拌器进行搅拌.反应中取指定浓度的柠檬酸溶液或银胶体250 mL于反应器,加入一定量的过氧化氢溶液,在紫外灯照射下连续搅拌反应,每隔30 min用微孔滤膜采样器(0.15 μm)取出5 mL溶液进行分析.
2.5 Ag胶体结构、形貌表征及浓度测定
采用日本岛津UV-1800紫外可见光分光光度计测定Ag胶体的紫外吸收曲线,波长的扫描范围为300~900 nm,以相应不含银的溶液作为参比;采用英国马尔文公司的Zetasizer Nano测定银胶体的粒径和ζ-电位;采用日本JEOL公司的JEM2010高分辨透射电子显微镜测定银胶体形貌,将样品分散于等体积的乙醇中,超声混合均匀后滴加到碳支持膜上,干燥后进行测试,加速电压为200 kV.采用日本岛津TOC-V CPH有机碳测定仪测定溶液的总有机碳来表征柠檬酸的氧化分解情况.Ag的浓度通过Thermo公司的ICP-MSXII进行测量,所有的待测样品中均加入一定量的优级纯硝酸溶液,抑制Ag物种的壁面吸附,并将原子态Ag转化为离子态以利于分析检测.
3 结果和讨论
3.1 Ag胶体形态分析
已有众多报道以联氨还原方法、辐照方法及以柠檬酸为还原剂或者稳定剂制备纳米Ag胶体,在这些以制备和形态控制为主旨的研究工作中,Ag+的初始浓度基本上在0.1 mol·L-1以上. 而核电站低放废液中核素浓度低于10-6 mol·L-1量级.本文旨在模拟低放废液水化学环境,研究其中Ag胶体存在的化学形态.为了能够进行分析检测,Ag+的初始浓度定为10-4 mol·L-1量级,重点研究当存在柠檬酸、还原剂联氨和钴源辐照的条件下,Ag能否形成纳米银颗粒,其形态具有怎样的形态特征. 样品的制备条件列于表 1.
表 1 银胶体的不同制备条件

3.1.1 紫外可见光谱结果
UV-Vis吸收光谱是纳米银颗粒的重要特性,不仅可以判断是否有纳米银颗粒形成,还可以通过吸收光谱峰的数量、峰位置来判断颗粒的粒径、形貌和所处的化学环境.图 1a给出了A、B、C、D 4种银胶体的UV-Vis吸收光谱图,可以看出,胶体A、B、C中都出现了纳米银的特征吸收峰,其最大UV-Vis吸收波长依次出现在408、418、396 nm处,此外,胶体A、B在700 nm附近,胶体C在900 nm 附近还有吸收峰.根据文献研究结果,不同形状的纳米银颗粒的紫外吸收峰的数目和位置不同,球形和类球形的银颗粒只有一个420 nm处的紫外吸收峰,而三棱柱和银纳米棒等其他形状的银颗粒在700~900 nm处有紫外吸收峰;此外,银颗粒粒径增大会使最大吸收波长红移,反之粒径减小则出现吸收峰的蓝移.从实验结果看,A、B、C 3种银胶体的Ag+都被还原并形成了银纳米颗粒,颗粒形状以球形和类球形为主,且都存在其他形状的Ag颗粒;3种银胶体相比,辐照与柠檬酸共存时颗粒度最小;柠檬酸与联氨共存时次之;单独联氨还原的样品颗粒度最大;单独Ag+在辐照条件下没有形成Ag纳米颗粒.
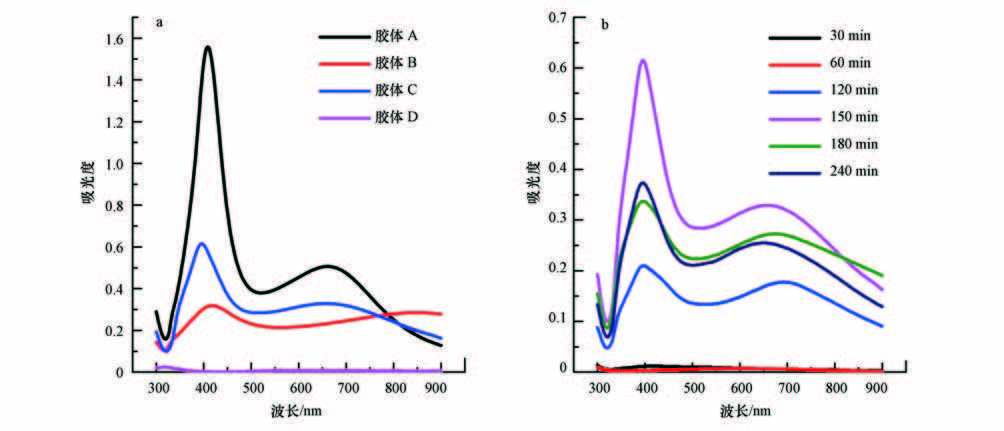
图 1银胶体的紫外可见光谱图(a.胶体A~D;b.胶体C不同辐照时间)
实验中将反应后的溶液进行离心分离,上清液经过0.15 μm的微孔过滤器采样,用ICP-MS测定了剩余Ag+的浓度,获得了A、B胶体中Ag+的还原率分别为91.49%和96.84%,而D胶体的Ag+还原率极低.样品C由于量少难以固液相彻底分离,仅采用NaCl溶液滴加的方法证明还存在未经还原的Ag+.
以上实验说明,联氨容易将Agaq+还原为纳米银颗粒,柠檬酸共存时还原率下降,颗粒粒径也减小.参考已有研究,可能是由于柠檬酸易与Ag+形成配合物,在还原过程中起到了缓释Ag+的作用,此外,柠檬酸也可作为稳定剂吸附于Ag纳米颗粒表面,减轻了颗粒之间的团聚生长.辐照条件无法使单独存在的Ag+还原,这是由于水在辐照环境下被激发电离,产生活性中间体既有具有还原性的e-、·H、H2,也有具有氧化性的·OH和H2O2,在只有AgNO3存在的体系中难以实现对Ag+的还原. 图 1b中给出了在有柠檬酸存在下随着辐照时间的延长Ag+逐渐被还原的过程,在此过程中柠檬酸起到了消耗氧化性活性中间体的作用,使得还原过程可以进行,水合电子将银离子还原为银原子,新生成的银原子聚集成核,生长成银纳米颗粒. 此外,柠檬酸同样也作为稳定剂阻止了颗粒的团聚长大,由图 1b中可见,球形颗粒对应的紫外光谱吸收波长变化不大.辐照150 min后,继续辐照将导致紫外吸收峰强度明显下降,可能是由于辐照产生的活性中间体破坏了银胶体的保护层,从而使得小颗粒聚集成大的团簇沉降在容器底部.
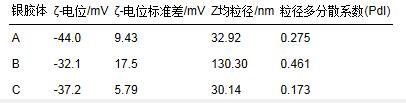
3.1.2 粒度与ζ-电位结果
对不同条件下获得的银颗粒的平均粒径和表面ζ-电位进行了测定,结果列于表 2. 胶体C中银的平均粒径最小,为30.14 nm;胶体A中银的平均粒径略大于胶体C,为32.92 nm;而胶体B中银的平均粒径最大,为130.3 nm.对比3种条件下的ζ-电位值可见,由于柠檬酸存在时起到了稳定剂的作用,使得Ag颗粒表面负电荷增多,阻止了颗粒的团聚长大;采用联氨直接还原获得的B样品,由于没有保护剂,表面所带的电荷较少,Ag颗粒的平均粒径较大.该结果与紫外光谱分析结果一致,柠檬酸的存在可以使Ag颗粒粒径减小.
表 2 银胶体的粒度与ζ-电位
3.1.3 TEM结果
图 2给出了银胶体A、B、C的TEM图.从图中可见,样品A中银纳米颗粒主要是球形的,有极少量的三棱柱银纳米片,颗粒度大多集中在20~40 nm之间;样品B中银纳米颗粒有明显的团聚现象,粒径在100 nm以上且形状不规则;样品C中银纳米颗粒与样品A中粒径接近,但分布更加均匀且均为球形,这体现了辐射法合成银胶体的产物粒径小、分布窄且易控制的特点. TEM结果与激光粒度仪和紫外可见光谱的结果相符.
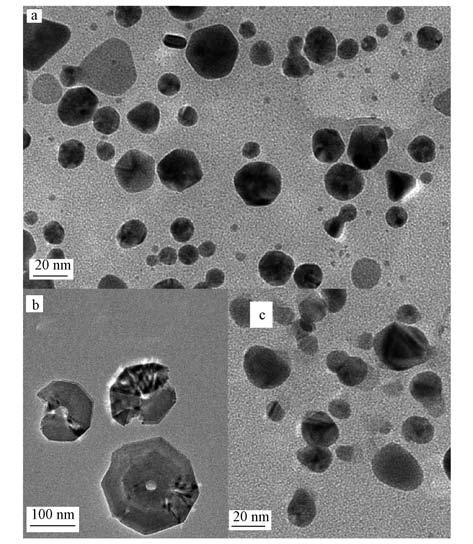
图 2银胶体的TEM图(a. 胶体A; b.胶体B; c. 胶体C)
3.2 不同形态银的吸附效果对比
从以上对Ag胶体形态的分析中可知,在模拟低放废液水化学环境下,工艺水中同时存在原子态Ag纳米颗粒和离子态Ag+,而且以Ag纳米颗粒为主,粒径在100 nm以上;在有柠檬酸等络合剂存在下的TER段废水中,柠檬酸既可以与Ag+形成离子态络合物,也可以参与Ag纳米颗粒的形成过程,使其粒径降低至约30 nm. 由于Ag物种结构的不同可能会导致其吸附去除性能的不同,这也可能是目前核电站中110mAg去除率不高的原因. 本文对比测定了2种电站常用离子交换树脂和1种分子筛吸附剂对不同形态银物种的去除性能. 测定的银物种包括硝酸银溶液、柠檬酸保护银胶体、银-柠檬酸离子态络合物,络合离子中柠檬酸与Ag+的摩尔比分别为10(银-柠檬酸离子态络合物A)、1(银-柠檬酸离子态络合物B)和0.1(银-柠檬酸离子态络合物C).
图 3给出了不同形态银的吸附效果(logKd值)的对比结果.从图中可以看出,各种吸附剂对银离子的吸附效果最好,柠檬酸保护银胶体次之,银-柠檬酸离子态络合物的去除性能最低,且随着柠檬酸加入比例的提高,银-柠檬酸络合离子的吸附效果进一步变差.

图 3不同吸附剂对不同形态银的吸附效果
3.3 高级氧化对柠檬酸及银胶体的效果
从不同银物种的吸附去除性能看,要提高对110mAg的净化性能,最有效的方法是通过高级氧化技术破坏柠檬酸与Ag的复合结构,使其转变为单独的Ag+.由于放射性废物最小量原则,核电站对加入的化学试剂有严格的限制,因此,本文采用无残留的UV+H2O2组合技术对柠檬酸和银胶体进行氧化降解.
3.3.1 单独柠檬酸和银胶体的高级氧化性能
图 4给出了不同的氧化方式和不同H2O2量对单独柠檬酸的氧化效果.可见,单独的H2O2对柠檬酸只有微弱的氧化效果,单独紫外线的氧化效果要好于H2O2,但仍远差于UV+H2O2组合技术.本文实验条件下使用UV+H2O2方法基本上20 min以内即可使柠檬酸的氧化率达到90%以上;H2O2浓度为0.3 mL·L-1时,氧化效果最好;H2O2浓度的增加或减少都会使氧化效果略微下降.

图 4柠檬酸的高级氧化(a:0.3 mL·L-1 H2O2;b:UV;c:UV+ 0.1 mL·L-1 H2O2;d:UV+0.3 mL·L-1 H2O2;e:UV+0.5 mL·L-1 H2O2)
图 5A给出了不同的氧化方式和不同H2O2量对以联氨还原剂制备的单独Ag胶体(样品B)的氧化效果.可见,单独UV对Ag胶体几乎没有氧化作用;H2O2对Ag胶体具有一定的氧化性能,当H2O2的加入量为0.3 mL·L-1时,5 min可达到稳定的氧化率(45%);UV与H2O2相结合可以迅速提高Ag胶体的氧化率,当H2O2加入量为0.3 mL·L-1和0.5 mL·L-1时,氧化率分别可达87%和93%. 图 5B中给出当H2O2加入量为0.1 mL·L-1时,Ag纳米颗粒的紫外吸收峰随着时间快速减弱,到27.6 min时,原子态Ag基本上被完全氧化.
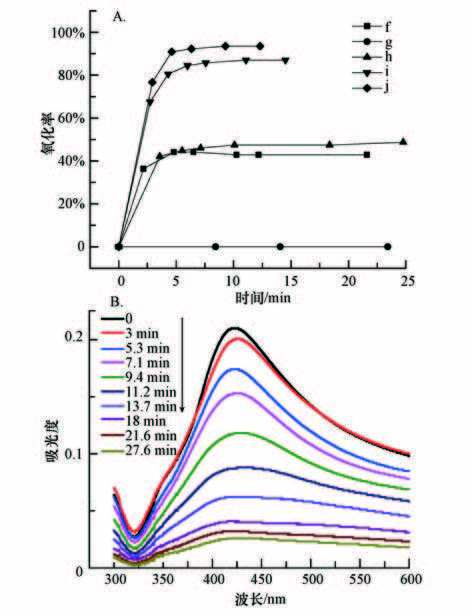
图 5单独银胶体的高级氧化性能(f:0.3 mL·L-1 H2O2;g:UV;h:UV+0.1 mL·L-1 H2O2;i:UV+0.30 mL·L-1 H2O2;j:UV+0.5 mL·L-1 H2O2)
3.3.2 柠檬酸稳定银胶体的高级氧化性能
图 6给出了3种氧化方式和H2O2添加量对柠檬酸稳定Ag胶体的氧化性能,其中,图 6A为Ag的氧化率,图 6B为以TOC方法测定的柠檬酸氧化率.与单独柠檬酸和单独Ag胶体氧化相似的是:单独UV仅对柠檬酸分解有较弱的作用,对Ag胶体氧化性能差;单独H2O2对Ag胶体有中等程度氧化作用,对柠檬酸氧化作用很弱. 但UV+ H2O2二者联用对柠檬酸和Ag胶体的氧化效果均迅速提高,且随着H2O2投加量的升高,氧化率升高. 考虑到核电站的特殊要求,尽量减少化学物质的投加量,本实验中当H2O2浓度为0.3 mL·L-1时,5 min内即可以将胶体中98%以上的Ag转变为离子形态Ag+释放出来,而柠檬酸的氧化率在20 min后达到80%,与单独柠檬酸氧化相比氧化率略有下降.
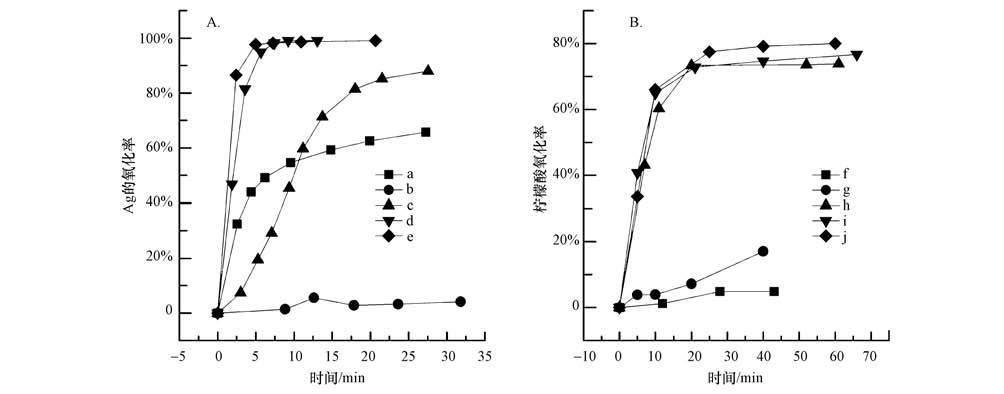
图 6柠檬酸稳定银胶体的高级氧化(a,f:0.3 mL·L-1 H2O2;b,g:UV;c,h:UV+0.1 mL·L-1 H2O2;d,i:UV+0.30 mL·L-1 H2O2;e,j:UV+0.5 mL·L-1 H2O2)
3.3.3 氧化动力学分析
为了研究Ag胶体和柠檬酸氧化的动力学特性,本文分别采用了伪一级(式(3))、伪二级(式(4))及改进的一级动力学模型(式(5)),对柠檬酸、单独Ag胶体及柠檬酸稳定Ag胶体的氧化过程进行了计算分析,结果列于表 3和表 4中.
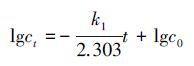
(3)
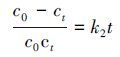
(4)
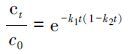
(5)
式中,t为反应时间(min),C0为被氧化物质的初始浓度(mg·L-1),Ct为被氧化物质t时刻的浓度(mg·L-1),k1是伪一级反应的速率常数(min-1),k2是伪二级反应的速率常数(L·mg-1·min-1),k1代表开始时反应速率的快慢,显然,k1越大初始反应速率越大,其主要取决于反应的初始条件如紫外线强度和双氧水浓度值等;而k2代表反应速率随时间的降低程度,k2越大反应速率随时间下降得越快,主要取决于反应过程中水质变化,如双氧水消耗速率等.
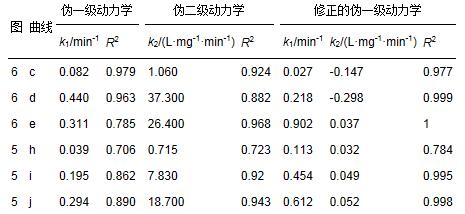
从表 3可见,单独柠檬酸的高级氧化较好地符合伪二级动力学方程,而柠檬酸稳定Ag胶体氧化过程中柠檬酸的氧化基本上更符合伪二级动力学方程,但计算的准确性不高;而采用黎雷等提出的改进一级动力学模型计算,准确度有较大的提高. 与单独柠檬酸氧化相比,柠檬酸稳定Ag胶体氧化过程中柠檬酸的初始氧化速率下降. 从表 4及计算结果可见,单独Ag胶体的氧化更符合伪二级动力学方程;而柠檬酸稳定Ag胶体氧化过程中,当H2O2浓度小于0.3 mL·L-1时,银胶体的氧化符合伪一级动力学方程,而当H2O2浓度为0.5 mL·L-1时,银胶体的氧化更符合伪二级动力学方程.采用改进一级动力学模型计算,同样可以提高准确度.
表 3 柠檬酸的高级氧化动力学计算
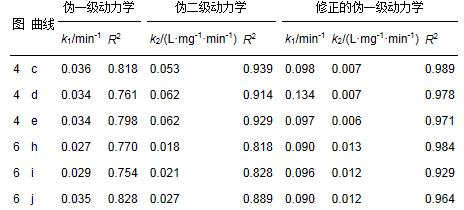
表 4 银胶体的高级氧化动力学计算
伪一级与伪二级动力学模型是一个较为理想的应用模型,其中假设反应速率为常数,而且体系中其他水化学参数不改变,或者对反应速率没有影响. 柠檬酸稳定Ag胶体氧化过程同时包括了Ag颗粒的氧化和柠檬酸的氧化两个反应,且二者之间有着复杂的关系,这可能导致了伪一级与伪二级模型计算精确度降低.
3.3.4 氧化后吸附效果
为了验证柠檬酸保护Ag胶体高级氧化不同阶段的吸附性能的提升程度,在UV+ 0.5 mL·L-1 H2O2的条件下取不同氧化时间的溶液对其进行吸附性能测试,结果如图 7所示.从图中可以看出,高级氧化确实提升了银的吸附效果.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
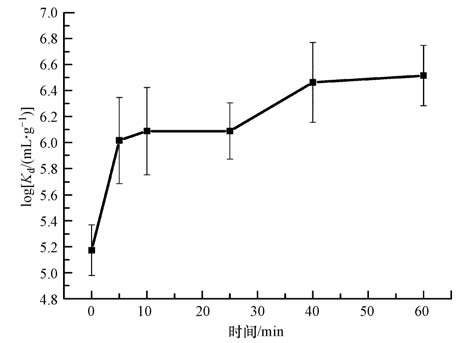
图 7分子筛13X对高级氧化不同阶段的银胶体的吸附性能
4 结论
本文模拟核电站低放废液的水化学环境,研究了放射性核素110mAg可能的存在形态,并对提高其净化性能提出了可行的方案.结果表明,在低放废液中同时存在原子态Ag纳米颗粒和离子态Ag+,在有络合剂柠檬酸存在条件下,柠檬酸可以形成Ag-柠檬酸络合离子及柠檬酸稳定的Ag胶体颗粒,柠檬酸的加入可以使Ag颗粒的粒径减小.常规使用的离子交换树脂和吸附剂对单独的Ag+具有最好的净化性能,但对胶体态Ag纳米颗粒、尤其是Ag-柠檬酸络合离子的净化性能较差.采用H2O2+UV的高级氧化技术可以将柠檬酸和原子态Ag氧化,从而使胶体态及络合态的Ag物种转变为单独的离子态Ag+,这样将大大提高离子交换树脂和无机吸附剂对Ag的去除性能,减轻110mAg的排放风险.
