1 引言(Introduction)
长期以来, 好氧生物处理工艺始终存在高耗能的弊端.一方面, 污水处理厂60%的能耗来自于鼓风机消耗, 目前我国污水处理厂的平均电耗为0.292 kW·h·m-3, 13%以上的污水厂电耗超过0.48 kW·h·m-3, 即使在美国, 其城市污水处理的电耗也要占总电耗的3%以上(曲久辉, 2014).另一方面, 城市污水作为资源循环利用的重要载体, 潜在能量巨大, 有待开发.然而, 目前我国城市污水的循环利用仅限于水资源的循环利用, 忽视了污水处理过程中有机质的循环利用.厌氧处理作为一种低成本的废水处理技术, 不仅可以进行污水处理, 而且可以实现能源回收, 近年来得到国内外学者的密切关注.
厌氧生物处理技术一般应用于处理高浓度有机废水, 而有关其用于处理低浓度生活污水的研究相对较少(McCarty, 1981).早在1989年, Sanz等就将厌氧流化床反应器(AFBR)应用于生活污水处理, 发现即使在低于10 ℃的低温环境下, COD去除率也能达到70%以上(Sanz et al., 1989; 1990), 但其COD与SS仍不能满足严格的污水处理排放标准.随着膜技术的发展, Fang等将膜技术与厌氧生物处理相结合, 开发了厌氧膜生物反应器(AMBR), 膜组件的加入有效地截留了固体悬浮物且避免了活性污泥的流失, 极大地提高了出水水质(Fang et al., 2006;Bérubé et al., 2006), 然而膜污染问题接踵而至.Kim等(2011)针对此问题, 加入颗粒活性炭, 利用颗粒活性炭作为生物载体, 并将其充分流化使其对膜组件进行冲刷, 开发了厌氧流化床膜生物反应器(AFMBR), 实验证明, 膜污染得到了一定程度的控制且出水状况良好.
然而, 这些厌氧膜生物反应器配水使用的有机物是醋酸盐或丙酸盐, 相对于生活污水中复杂的有机污染物来说更容易被降解利用.为此, 本研究以蔗糖、蛋白胨为碳源对AFMBR的运行进行探究.张博康等(2018)对AFMBR的能耗及产能进行了实验分析, 结果表明, 若只考虑气态甲烷产能, 当HRT降至10 h时, 该系统产能已是能耗需求的2倍, 因此, AFMBR作为一种低耗高效的废水处理系统, 具有良好的发展潜力.
厌氧微生物是污水厌氧消化的主体.在厌氧消化反应器中, 底物的差异对污泥中微生物群落结构的形成及代谢过程有重要影响(Fernandez et al., 2008).即使在处理相同底物的不同厌氧消化反应器中, 微生物群落仍呈现不同结构(刘君寒等, 2011).本实验系统采用的碳源为蔗糖、蛋白胨, 相对于醋酸盐和丙酸盐这类碳源更复杂、更难降解与利用, 且目前有关AFMBR系统微生物的研究较少.因此, 本研究利用宏基因组测序及高通量技术, 从微生物菌群、功能基因、代谢途径等不同角度对AFMBR系统进行分析, 探寻微生物群落结构变化规律与厌氧消化的内在关系, 以期为AFMBR高效稳定的运行提供科学依据, 同时推动厌氧污水处理技术的进步与发展.
2 材料与方法(Materials and method)
2.1 反应器的构造及运行条件
厌氧流化床膜生物反应器(AFMBR)如图 1所示(张博康等, 2018).AFMBR由一个主反应柱和两个沉淀室组成, 其有效容积为30 L.在主反应柱内部设置有60根1 m长的聚偏氟乙烯(PVDF)中空纤维膜(公称孔径为0.4 μm), 总有效面积为0.2475 m2.
图 1

图 1 AFMBR系统示意图(1.进水蠕动泵, 2.反应柱, 3.沉淀室, 4.循环磁力泵, 5.转子流量计, 6.压力传感器, 7.出水蠕动泵, 8.颗粒活性炭, 9.中空纤维膜, 10.pH电极, 11.ORP电极, 12.DO电极, 13.液位控制器, 14.集气)
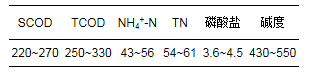
AFMBR的实验用水为模拟生活污水, 其水质组成参照冯华军等(2011)对浙江省典型地区生活污水水质检测数据, 进行人工模拟配水, 其配水水质如表 1所示, 其中, 有机碳源组分主要为蔗糖和蛋白胨, 此外, 还包含有NH4HCO3、尿素、K2HPO4、KH2PO4、NaHCO3.
表 1 本次研究中试验废水水质
AFMBR系统连续运行218 d, 整个过程分为4个阶段.系统内的pH维持中性, 温度为20~38 ℃, ORP在-506 mV左右, 均满足厌氧微生物的需要, 不需人为调整.
2.2 样品采集
AFMBR的接种污泥取自北京市某污水厂的污泥浓缩池, 污泥浓度(MLVSS)为80.35 g·L-1.AFMBR运行前, 取种泥经离心后放入超低温冰箱中(-76 ℃)以备高通量测序.AFMBR运行结束时, 自取样口2、3、4(图 1)取泥样.从取样口2、3、4采集颗粒活性炭, 经液氮冷冻、研磨后放入超低温冰箱中以备宏基因组测序.
2.3 高通量测序
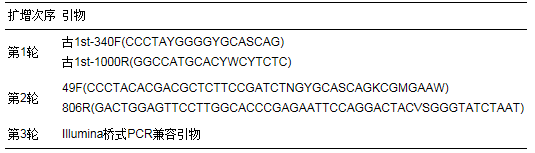
接种污泥委托上海生工公司进行高通量测序, 具体步骤参照谭潇等(2017)的研究.首先提取DNA, 对种泥细菌16S rDNA基因的V3区进行PCR两轮扩增, 引物如表 2所示.对种泥古菌16S rDNA基因的V3~V4区进行3轮扩增, 引物如表 3所示.细菌和古菌扩增的PCR产物和正常扩增片段在400 bp以上的PCR产物, 选用0.6倍的磁珠(Agencourt AMPure XP)进行处理.继而利用Qubit2.0 DNA检测试剂盒对回收的DNA精确定量, 按照1:1等量混合后测序.等量混合时, 每个样品DNA量取10 ng, 最终上机测序浓度为20 pmol.
表 2 AFMBR系统接种菌群细菌所用引物
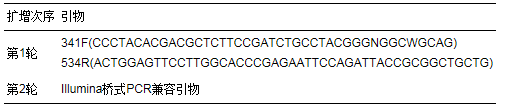
表 3 AFMBR系统接种菌群古菌所用引物
2.4 宏基因组测序
AFMBR系统连续运行结束后的泥样委托上海生工公司进行宏基因组测序.宏基因组测序是对系统内的功能基因进行进一步的分析, 从基因角度分析系统的代谢过程, 同时也对系统内微生物组分进行分析.宏基因组测序的DNA提取方法与高通量测序方法相同, DNA在琼脂糖凝胶电泳检测后, 使用Covaris仪器通过超声波将DNA片段化, 选择合适的打断参数条件使打断的DNA片段大小集中在300~500 bp范围内.样品片段化结束后, 对其进行末端修复并再次进行片段化.连接接头后, 采用NEBNext Q5 Hot Start HiFi PCR Master Mix扩增PCR.PCR结束后, 利用0.6倍的Agencourt AMPure XP-核酸纯化磁珠对PCR反应产物进行纯化, 并通过2%琼脂糖凝胶电泳检测构建完整的文库PCR纯化产物.使用DIAMOND将基因集蛋白序列与Nr (NCBI non-redundant protein sequences)数据库进行blastp同源性比对, 得到功能注释和同源物种信息, 筛选条件:E-value < 1×10-5, Score>60.同时根据NCBI的微生物分类学信息数据库, 获得基因的物种分类注释信息, 并在Kingdom (界)、Phylum (门)、Class (纲)、Order (目)、Family (科)、Genus (属)、Species(种)各个分类学水平上统计物种的相对丰度.使用GhostKOALA将基因集蛋白序列与KEGG数据库进行比对, 得到序列对应的KO号, 根据KO与Pathway和Module的联系得到序列的Pathway、Module注释信息, 并统计KEGG各功能层级在各个样本中的丰度.
3 结果与讨论(Results and discussion)
3.1 AFMBR系统运行特性
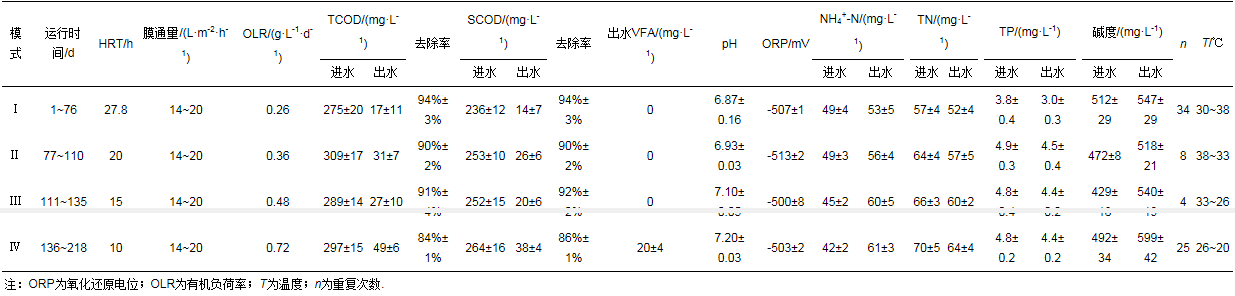
AFMBR反应器的运行工况及条件如表 4所示(张博康等, 2018).AFMBR系统连续运行结束时的数据表明, 经过驯化富集后系统的出水COD能稳定维持在30 mg·L-1以下, COD满足一级A出水标准(GB18918—2002);其中, 进水COD约有50%转化为甲烷;污泥产量为0.076 g·g-1 (以每克COD中的VSS计), 远低于典型的好氧系统的污泥产量;如若只考虑气态甲烷产能, HRT为10 h时产能已是能耗需求的2倍(张博康等, 2018).
表 4 AFMBR系统的运行特性
3.2 AFMBR系统运行前后菌群在属水平的变化
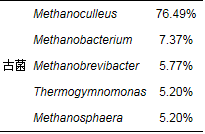
AFMBR接种污泥的微生物菌群在属水平上的相对丰度(>1%)如表 5所示.从表 5中可以看出, 接种菌群中细菌在属水平的相对丰度以Petrimonas、Syntrophomonas、Alkaliphilus占比较高, 分别为7.71%、5.78%、5.42%;此外, 还有Tissierella、Nitrobacter等许多其它菌属.接种菌群中古菌在属水平的相对丰度以Methanoculleus菌属占比较高, 占所有古菌的76.49%.Methanobacterium、Methanobrevibacter、Thermogymnomonas等菌属占比较小.
表 5 AFMBR系统接种菌群属水平的相对丰度

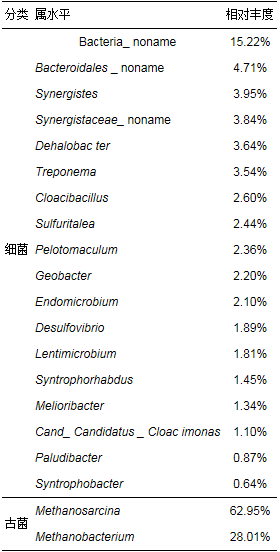
AFMBR系统运行结束时菌群在属水平的平均相对丰度(>1%)如表 6所示.从表 6中可以看出, 与种泥相比, 运行结束时细菌与古菌的优势菌属变化均较大.细菌菌属除去未命名的菌属, 占比较高的Synergistes、Dehalobacter、Treponema分别占3.95%、3.64%、3.54%.古菌菌属主要为Methanosarcina(甲烷八叠球菌属)和Methanobacterium(甲烷杆菌属), 分别占62.95%、28.01%.AFMBR系统接种细菌菌属中的Petrimonas必须以单质硫和硝酸盐为电子受体(Grabowski et al., 2015);Syntrophomonas以质子为电子受体, H2作为电子吸收产物, 且在有H2存在的环境中会受到明显抑制(Mcinerney et al., 1981);Alkaliphilus是一种极度嗜碱微生物(Takai, 2001);Nitrobacter为硝化菌, 需在好氧条件下生存.Petrimonas、Syntrophomonas、Alkaliphilus与Nitrobacter皆因AFMBR系统无法提供相应的生存条件而被筛选淘汰.AFMBR系统运行结束时细菌菌属中的Synergistes、Dehalobacter皆为专性厌氧细菌, Dehalobacter可利用乳酸产氢产乙酸, 且可通过产生的氢气脱氯(Yoshida et al., 2009;Kato et al., 2010;Li et al., 2015), Synergistes也恰好须与耗氢微生物互养.系统的严格厌氧条件更有利于这些菌属生长, 其代谢途径也与厌氧微生物的碳代谢过程相吻合, 因此, 属水平上的种群变化是该反应器高效能的直接体现.
表 6 AFMBR系统运行结束时菌群属水平的平均相对丰度
从古菌菌属来看, 系统运行前后的产甲烷菌属占比分别为90.94%与91.01%, 但优势菌属由接种时的Methanoculleus(76.49%)转变为Methanosarcina(62.95%)与Methanobacterium(28.01%).基于代谢基质差异分类, Methanoculleus、Methanosarcina与Methanobacterium分别属于氢营养型产甲烷菌群、乙酸营养型产甲烷菌群与多营养型产甲烷菌群.由此可得出AFMBR系统产甲烷基质由最初的主要以氢气提供为主转变为以乙酸为主.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
3.3 AFMBR系统运行结束时菌群在种水平的特性
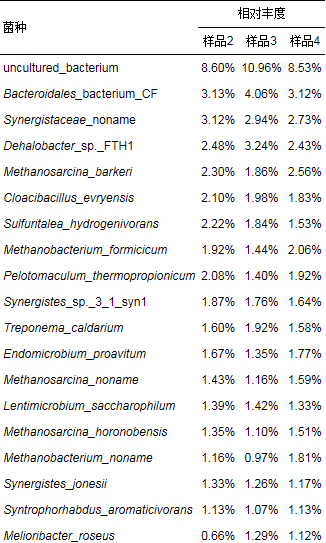
依据宏基因组分析, AFMBR系统运行结束时菌群在种水平的相对丰度如表 7所示.从表 7中可以看出, 各菌种所占的比例相差不大, Bacteroidales_bacterium_CF、Synergistaceae_noname、Dehalobacter_sp._FTH1、Methanosarcina_barkeri等菌种的占比略高于其他菌种.
表 7 AFMBR系统运行后菌群在种水平的相对丰度

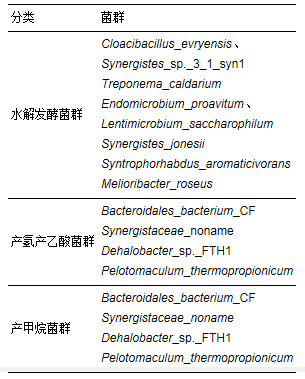
对表 7中的微生物菌种进行分析, 依据厌氧消化三阶段理论进行分类, 具体如表 8所示.水解发酵菌群中Cloacibacillus_evryensis、Synergistes_jonesi能够发酵氨基酸, 不能在糖类、有机酸/醇内生长(Ganesan et al., 2008).而Treponema_caldarium、Endomicrobium_proavitum、Lentimicrobium_saccharophilum则能够发酵碳水化合物, 不同底物的发酵产物也不尽相同(Bravo et al., 2013;Sun et al., 2016;Zheng et al., 2016).Synergistes_sp._3_1_syn1能够产生天冬氨酸蛋白酶分解蛋白质(Kumar et al., 2010;Walsh et al., 2015).Syntrophorhabdus_aromaticivorans在与氢营养型产甲烷菌共培养时能够降解苯酚, 代谢产物为乙酸和甲烷(Qiu et al., 2008).Melioribacter_roseu是兼性厌氧菌, 可以通过好氧呼吸在单糖、二糖及多糖中生长, 也可以通过还原不同的电子受体(亚硝酸盐、Fe(Ⅲ)、As(Ⅴ))进行发酵(Kadnikov et al., 2013;Tsapekos et al., 2017).
表 8 AFMBR系统内厌氧菌群分类
产氢产乙酸菌群中Bacteroidales_bacterium_CF可以发酵乳酸和乙醇(Tang et al., 2013).Dehalobacter_sp._FTH1是厌氧脱卤杆菌的一种, 可以利用乳酸产氢产乙酸, 并且可以通过产生的氢气脱氯(Yoshida et al., 2009;Kato et al., 2010;Li et al., 2015).Pelotomaculum_thermopropionicum是一种厌氧生物降解系统中典型的互养菌, 能够促进中间产物的转化, 且能够将发酵细菌产生的VFA和乙醇转化为乙酸盐、氢气和二氧化碳(Kato et al., 2010;Leng et al., 2017).
产甲烷菌群中, Methanosarcina_barkeri、巴氏甲烷八叠球菌属可以利用甲醇、醋酸、甲胺及不同形式的氢和二氧化碳, 虽然其生长缓慢, 但能适应环境中各种可用的能源, M. barkeri可以在低pH的生态系统存活, 并且能够有效地中和酸性环境, 相对于其他的产甲烷菌抗冲击性更强(Rocheleau, 1999;Lin et al., 2017);Methanobacterium_formicicum是甲酸甲烷杆菌, 利用分子态氮为氮源进行生长, 细菌产生甲烷的速率与氮气浓度有关, 在没有氮气或其他氮源的情况下, 细菌完全停止生长(Schauer et al., 1980;Magingo et al., 1991).
通过对AFMBR运行后的菌群进行分析可以看出, 在AFMBR运行一段时间后, 各菌种之间相互影响, 不存在较明显的优势菌种, 各菌种的占比相差不大.空间上从下至上分别取样品2、3、4, 从相对丰度比例>1%的菌种来看, 样品2、3、4中属于水解发酵菌群的相对丰度分别为11.75%、12.05%、11.57%, 属于产氢产乙酸菌群的相对丰度分别为10.81%、11.64%、10.20%, 属于产甲烷菌群的相对丰度分别为9.05%、7.26%、10.55%.从中可以看出, 水解发酵菌群相对较多, 其次是产氢产乙酸菌群, 产甲烷菌群相对最少, 但它们之间差距较小.造成这种趋势的原因与厌氧消化过程密切相关, 水解发酵菌群为产氢产乙酸菌群提供反应底物, 产氢产乙酸菌群为产甲烷菌群提供反应底物.因此, 在一个稳定的系统内, 各类菌群的相对数量不会相差过大, 这也是该系统为何能达到90%以上COD去除率的原因之一.
样品2、3、4在species水平上的多样本比较Venn图如图 2所示.从图 2中可以看出, 样本2、3、4共有菌种8061种, 占据绝大多数, 表明各样本间的菌种没有太大差别, 系统内的菌群分布比较均匀, 几乎不存在空间差异.这与AFMBR系统采用水流循环的形式, 使颗粒活性炭充分流化, 加大了水与微生物之间的传质有关, 从而促进了反应器的高效运行.
图 2

图 2样品2、3、4在species水平上的多样本比较Venn图
3.4 基因的KEGG功能注释
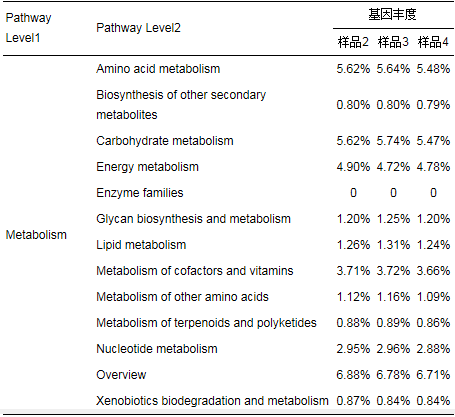
KEGG(Kyoto Encyclopedia of Genes and Genomes)是有关生物系统较完善的数据库, 整合了基因组、化学物质和系统功能信息.其中, KEGG GENES搜集了所有已知的完整的基因组的基因蛋白序列, 包含每个基因的最低限度信息.KEGG Pathway存储了各种生物学通路信息, 包括代谢通路、合成通路、膜转运、信号传递、细胞周期及疾病相关通路等.样品2、3、4的KEGG Pathway基因丰度统计如表 9所示.Pathway Level1的Metabolism中, 基因丰度最高的是Overview, 其次依次分别为Carbohydrate metabolism、Amino acid metabolism和Energy metabolism.其中, Carbohydrate metabolism为碳水化合物代谢, 样品2、3、4的相对丰度分别为5.62%、5.74%、5.47%;Amino acid metabolism为氨基酸代谢, 样品2、3、4的相对丰度分别为5.62%、5.64%、5.48%.这与本次实验用水水质有关, 实验废水中的有机物分别为蔗糖和蛋白胨, 因此, 针对这两部分的功能基因数目较多, 较为活跃.关于Energy metabolism, 样品2、3、4的相对丰度分别为4.90%、4.72%、4.78%, 其中大部分功能基因与厌氧消化菌群中产甲烷菌的产甲烷过程有关, 这使得反应器有较高的甲烷产率及COD去除率.
表 9 KEGG Pathway Metabolism基因丰度统计
样品2、3、4的Pathway Level 3分类统计柱状图如图 3所示.从图 3中可以看出, ko01230、ko01200的基因丰度明显高于其他类别, 其中, ko01230(Biosynthesis of amino acids)为氨基酸的生物合成, 样品2、3、4的相对丰度分别为3.78%、3.71%、3.67%;ko01200(Carbon metabolism)为碳代谢, 样品2、3、4的相对丰度分别为3.72%、3.64%、3.63%.ko01230、ko01200均属于Pathway Level2中的Overview.此外, 图 3中ko00680(Methane metabolism)为甲烷代谢, 样品2、3、4的相对丰度分别为1.72%、1.54%、1.73%.
图 3

图 3样品2、3、4的Pathway Level3分类统计柱状图
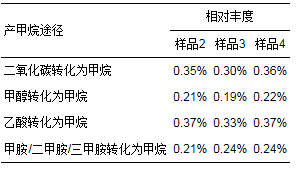
甲烷代谢过程中的产甲烷途径有4种, 分别是二氧化碳转化为甲烷、甲醇转化为甲烷、乙酸转化为甲烷及甲胺/二甲胺/三甲胺转化为甲烷.样品中各产甲烷途径的基因相对丰度如表 10所示.从表 10中可以看出, 二氧化碳转化为甲烷、乙酸转化为甲烷的基因丰度相对较高, 是系统产甲烷的主要途径;其次, 甲醇转化为甲烷、甲胺/二甲胺/三甲胺转化为甲烷的基因丰度也占有较大比例, 也是系统产甲烷过程的重要组分.
表 10 样品中各产甲烷途径的基因相对丰度
4 结论(Conclusions)
1) 与接种菌群相比, AFMBR运行一段时间后微生物的优势菌属发生了较大的变化.其中, 细菌优势菌属由接种时的Petrimonas转变为Bacteria_noname(未命名的细菌菌属), 古菌菌属由接种时的甲烷囊菌属转变为甲烷八叠球菌属和甲烷杆菌属, 可以推测产甲烷基质由最初的氢气为主转变为乙酸为主.
2) AFMBR运行一段时间后, 从相对丰度≥1%的菌种来看, 其中, 水解发酵菌群的相对丰度最高, 其次为产氢产乙酸菌群, 产甲烷菌群相对最少, 但各菌群之间相对丰度的差距较小.
3) AFMBR运行一段时间后, 系统内的菌群分布比较均匀, 空间上不存在明显的菌群结构差异.这与AFMBR系统采用水流循环的形式, 使颗粒活性炭充分流化, 加大了水与微生物之间的传质有关.
4) AFMBR系统内与代谢通路相关的碳水化合物代谢、氨基酸代谢、能量代谢基因丰度较高.二氧化碳转化为甲烷、乙酸转化为甲烷是系统产甲烷的主要途径.此外, 甲醇转化为甲烷、甲胺/二甲胺/三甲胺转化为甲烷也是系统产甲烷过程的重要组分.(来源:环境科学学报 作者:陈昌明)