申请日2014.10.29
公开(公告)日2015.01.28
IPC分类号C12R1/01; C12N1/20
摘要
本发明公开了一种从活性污泥中分离纯化蛭弧菌的方法,通过关键的宿主菌筛选、活性污泥预处理技术,培养基及培养液的调配和培养条件的优化等技术步骤,借助自活性污泥中获得的革兰氏阴性细菌作为分离纯化蛭弧菌的宿主细菌,经过一系列关键步骤的优化从同源污泥样品中分离纯化出高效蛭弧菌。本发明不仅首次提出自市政污水处理厂活性污泥中成功分离高效蛭弧菌的方法,并显著缩短了其培养周期,克服了目前常规方法中蛭弧菌分离效果不稳定、培养周期长、操作繁琐等缺陷。
权利要求书
1.一种从活性污泥中分离纯化蛭弧菌的方法,其特征在于,该方法包括以下步骤:
1)自污泥样品中筛选分离宿主菌及其菌悬液的制备:首先将市政污水处理厂二沉池的活性污泥作为污泥样品,从中分离筛选出革兰氏阴性菌,然后将所述革兰氏阴性菌作为宿主细菌,对其进行液体增殖18~24h后,经离心分离获取菌斑;最后对所获菌斑用无菌磷酸盐缓冲液进行重悬得到宿主菌悬液,将其在4℃下保存;
2)对污泥样品进行预处理以获得蛭弧菌原液,具体流程为:将筛选宿主菌的同源污泥样品涡旋振荡30~60min,室温静置20~30min后,利用高速冷冻离心机在4~10℃、转速为800×g~1000×g条件下离心 15~25min,取上清液,然后将上清液在4~10℃、转速为15000×g~30000×g下离心20~30min,取沉淀,并用无菌磷酸盐缓冲液重悬,所获重悬液即为蛭弧菌原液;
3)按照以下流程进行蛭弧菌的分离,然后对得到的混合液按照该流程至少重复进行三次纯化,得到纯蛭弧菌:首先采用稀释营养肉汤双层琼脂平板法进行蛭弧菌的分离,然后将分离得到的蛭弧菌加入到稀释营养肉汤培养液中,并向其中加入所述步骤1)得到的宿主菌悬液,其体积占稀释营养肉汤培养液的0.5%~1%,涡旋振荡混匀后,转移至25~30℃、150~200r/min的水浴恒温摇床中液增3~5天,将增殖液梯度稀释105~107倍,取各梯度稀释液与宿主菌悬液混合;
4)纯蛭弧菌悬液的制备:将所述步骤3)得到的纯蛭弧菌的菌斑加入到无菌稀释营养肉汤培养液中,并向其中加入所述步骤1)得到的宿主菌悬液,其体积占稀释营养肉汤培养液的0.5%~1%,转移至25~30℃、150~200r/min的水浴恒温摇床中培养3~5天,所获得的增殖液即为纯蛭弧菌悬液。
2.根据权利要求1所述的从活性污泥中分离纯化蛭弧菌的方法,其特征在于,所述步骤3)中采用稀释营养肉汤双层琼脂平板法进行蛭弧菌的分离的具体流程为:对蛭弧菌原液进行梯度稀释,取蛭弧菌各梯度稀释液与宿主菌悬液混匀,并向其中加入3~7mL保温在50~55℃之间的上层琼脂培养基,经涡旋振荡混匀后,均匀平铺在预制的已凝固的下层琼脂培养基上,待上层琼脂培养基凝固后放入25~30℃的恒温生化培养箱中培养2~4天。
3.根据权利要求1或2所述从活性污泥中分离纯化蛭弧菌的方法,其特征在于,所述步骤3)中,在所有分离纯化过程中所使用的琼脂培养基和稀释营养肉汤培养液的pH均需调节在6.8~7.5之间。
4.根据权利要求1或2所述从活性污泥中分离纯化蛭弧菌的方法,其特征在于,所述步骤3)中,双层琼脂平板法中所使用的琼脂培养基中还包括质量浓度为0.25‰~0.35‰的CaCl2、质量浓度为0.40‰~0.50‰的MgCl2。
5.根据权利要求1或2所述从活性污泥中分离纯化蛭弧菌的方法,其特征在于,所述步骤3)和步骤4)中使用的宿主菌悬液的浓度为 108~1012cfu/mL,所述步骤3)中,蛭弧菌梯度稀释液与宿主菌悬液混合的浓度比为1/10~1/100。
说明书
一种从活性污泥中分离纯化蛭弧菌的方法
技术领域
本发明属于微生物技术领域,涉及到一种从市政污水处理厂二沉池活性污泥中分离纯化蛭弧菌的优化方法。
背景技术
蛭弧菌类生物(Bdellovibrio-and-like organisms,简称蛭弧菌)是一类以捕食宿主细菌为生的小型寄生性细菌,蛭弧菌个体较小,宽0.2~0.6μm,长0.5~2.0μm,能透过0.45μm 的微孔滤膜,菌体呈弧状或杆状,是一种好氧的革兰氏阴性细菌,它可以侵嗜悬浮细菌,对环境中大多数科、属的革兰氏阴性细菌和少数革兰氏阳性细菌具有很高的裂解活性。因此蛭弧菌具有的独特生态学优势,可视为环境自然净化的重要生物因子之一,并可应用于疾病生态防治、农业种植、畜牧与水产养殖、水质净化、人畜卫生安全监控等方面。但目前从市政污泥中分离蛭弧菌用于污水处理厂尾水处理与污泥减量的研究鲜有报道。因此,有必要首先寻找一种稳定高效的从市政污泥中分离具有噬菌作用的蛭弧菌的方法。
常规的蛭弧菌分离方法在操作过程中会受到多种因素的影响,如不恰当的样品预处理手段、培养基中琼脂粉的浓度、培养基中所含的营养成分、Ca2+和Mg2+ 等微量元素的浓度,pH以及分离蛭弧菌时所选用的宿主细菌及其浓度、培养温度等,若条件控制不当,不仅会延长培养周期,甚至会导致蛭弧菌分离的失败。本发明中涉及到的改进方法是经过多次的实验探索后,逐渐形成的一套完整的从市政污泥中分离纯化蛭弧菌的方法体系,包括样品的预处理以及各项培养条件的优化与分离纯化。通过采用本方法,研究人员多次从不同污泥样品中分离获得高效蛭弧菌。
发明内容
技术问题:本发明充分考虑到蛭弧菌分离过程中各种因素的影响,提供一种能够得到稳定高效蛭弧菌、高效的从活性污泥中分离纯化蛭弧菌的方法。
技术方案:本发明从活性污泥中高效分离蛭弧菌的方法,包括以下步骤:
1)自污泥样品中筛选分离宿主菌及其菌悬液的制备:首先将市政污水处理厂二沉池的活性污泥作为污泥样品,从中分离筛选出革兰氏阴性菌,然后将所述革兰氏阴性菌作为宿主细菌,对其进行液体增殖18~24h后,经离心分离获取菌斑;最后对所获菌斑用无菌磷酸盐缓冲液进行重悬得到宿主菌悬液,将其在4℃下保存;
2)对污泥样品进行预处理以获得蛭弧菌原液,具体流程为:将筛选宿主菌的同源污泥样品涡旋振荡30~60min,室温静置20~30min后,利用高速冷冻离心机在4~10℃、转速为800×g~1000×g条件下离心 15~25min,取上清液,然后将上清液在4~10℃、转速为15000×g~30000×g下离心20~30min,取沉淀,并用无菌磷酸盐缓冲液重悬,所获重悬液即为蛭弧菌原液;
3)按照以下流程进行蛭弧菌的分离,然后对得到的混合液按照该流程至少重复进行三次纯化,得到纯蛭弧菌:首先采用稀释营养肉汤双层琼脂平板法进行蛭弧菌的分离,然后将分离得到的蛭弧菌加入到稀释营养肉汤培养液中,并向其中加入所述步骤1)得到的宿主菌悬液,其体积占稀释营养肉汤培养液的0.5%~1%,涡旋振荡混匀后,转移至25~30℃、150~200r/min的水浴恒温摇床中液增3~5天,将增殖液梯度稀释105~107倍,取各梯度稀释液与宿主菌悬液混合;
4)纯蛭弧菌悬液的制备:将所述步骤3)得到的纯蛭弧菌的菌斑加入到无菌稀释营养肉汤培养液中,并向其中加入所述步骤1)得到的宿主菌悬液,其体积占稀释营养肉汤培养液的0.5%~1%,转移至25~30℃、150~200r/min的水浴恒温摇床中培养3~5天,所获得的增殖液即为纯蛭弧菌悬液。
本发明方法的优选方案中,步骤3)中采用稀释营养肉汤双层琼脂平板法进行蛭弧菌的分离的具体流程为:对蛭弧菌原液进行梯度稀释,取蛭弧菌各梯度稀释液与宿主菌悬液混匀,并向其中加入3~7mL保温在50~55℃之间的上层琼脂培养基,经涡旋振荡混匀后,均匀平铺在预制的已凝固的下层琼脂培养基上,待上层琼脂培养基凝固后放入25~30℃的恒温生化培养箱中培养2~4天。
本发明方法的优选方案中,步骤3)中,在所有分离纯化过程中所使用的琼脂培养基和稀释营养肉汤培养液的pH均需调节在6.8~7.5之间。
本发明方法的优选方案中,步骤3)中,双层琼脂平板法中所使用的琼脂培养基中还包括质量浓度为0.25‰~0.35‰的CaCl2、质量浓度为0.40‰~0.50‰的MgCl2。
本发明方法的优选方案中,步骤3)和步骤4)中使用的宿主菌悬液的浓度为 108~1012cfu/mL,所述步骤3)中,蛭弧菌梯度稀释液与宿主菌悬液混合的浓度比为1/10~1/100。
本发明方法以稀释营养肉汤双层琼脂平板法为基础,整个分离过程涉及到宿主细菌的分离筛选、污泥样品的预处理、双层琼脂培养基的配制及培养条件的优化改进,以及蛭弧菌的分离与纯化。本发明方法的采用,不仅提供了从市政污泥中筛选高效蛭弧菌的途径,并且有效简化了操作步骤、提高了蛭弧菌在双层平板上的分离效果、显著缩短了其培养周期。
有益效果:与现有技术相比,本发明具有以下优点:
本发明内容包括自市政污水处理厂活性污泥中筛选分离宿主细菌、污泥样品的特定预处理、培养基的调配及培养过程中相关因素的调整与优化,直至蛭弧菌的分离与纯化。
本发明中的蛭弧菌和宿主细菌均筛选分离自来源相同的市政污水处理厂二沉池活性污泥,为蛭弧菌提供营养成分的宿主细菌与蛭弧菌的同源性大大缩短了蛭弧菌生长周期中停滞期的时间,有利于蛭弧菌迅速适应培养环境,加速自身增殖生长,从而有效缩短培养周期,而常规的分离通常是从研究机构购买一种特定宿主菌,很少有从源头上筛选宿主细菌进行蛭弧菌的分离,这样就会导致蛭弧菌对某一种宿主细菌具有极强的依赖性,一旦离开这种细菌,蛭弧菌噬菌特性可能就会渐渐消失,但是本发明的目的是为了筛选出稳定高效的蛭弧菌,所以在蛭弧菌的来源上本发明有其独到之处。
在进行蛭弧菌分离之前,本发明需要对污泥样品进行特定的预处理,以获得蛭弧菌原液,此种方式能够将绝大多数的悬浮颗粒物、原生动物和病毒在离心过程中得到去除,从而得到浓度较高的蛭弧菌原液,有利于快速分离到蛭弧菌,若不进行恰当的预处理,会直接影响后续出斑效率和蛭弧菌分离效果。
另外,蛭弧菌对生存环境的要求非常高,为了进一步提高蛭弧菌的增殖分离效率,本发明对培养过程中的培养条件(pH、培养基和培养液营养成分的配比、培养温度等)再次进行优化。如鉴于二沉池活性污泥的pH约在6.8~7.5之间,本发明控制培养基和培养液最佳pH的范围在6.8~7.5之间;另外,考虑到蛭弧菌的生长需要Ca2+、Mg2+等微量元素的摄入,本发明所使用的培养基均额外添加了相应浓度的Ca2+、Mg2+,以有利于蛭弧菌在最短时间内获取充分的营养进行增殖。结果发现蛭弧菌入侵宿主细菌体内的速度明显加快,蛭弧菌的出斑时间也从现有方法的4~6天缩短至2~3天,出斑效率明显提高。
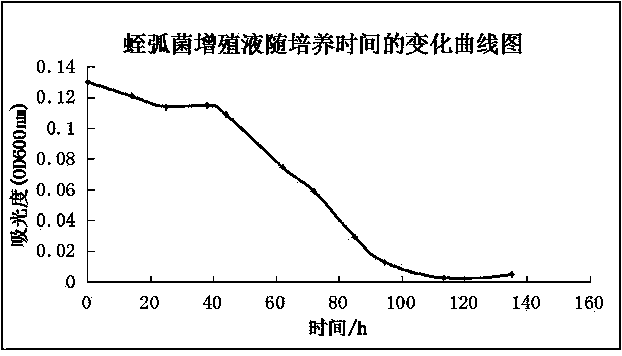
利用本发明所获得的蛭弧菌,在其液体增殖培养过程中,蛭弧菌裂解宿主细菌的速度和自身增殖速度明显加快,而且经传代培养其仍然具有高效稳定的裂解特性。但由于蛭弧菌个体微小,无法用显微镜直接计数获得细菌增殖后的浓度,故通过测定宿主菌和蛭弧菌混合液中宿主菌浓度降低导致的菌液吸光度的减弱来间接指示蛭弧菌的增殖生长。通过研究,蛭弧菌增殖液在第3天明显由浊变清,第4天吸光度基本降为0,预示宿主菌基本被裂解完成,蛭弧菌生长浓度达到极限值。本发明从二沉池活性污泥中所分离的高效蛭弧菌对于污泥破壁减量和尾水处理的研究都具有潜在的应用前景,极具研究价值。