申请日2015.03.31
公开(公告)日2015.08.12
IPC分类号C01D7/22; C01D7/00
摘要
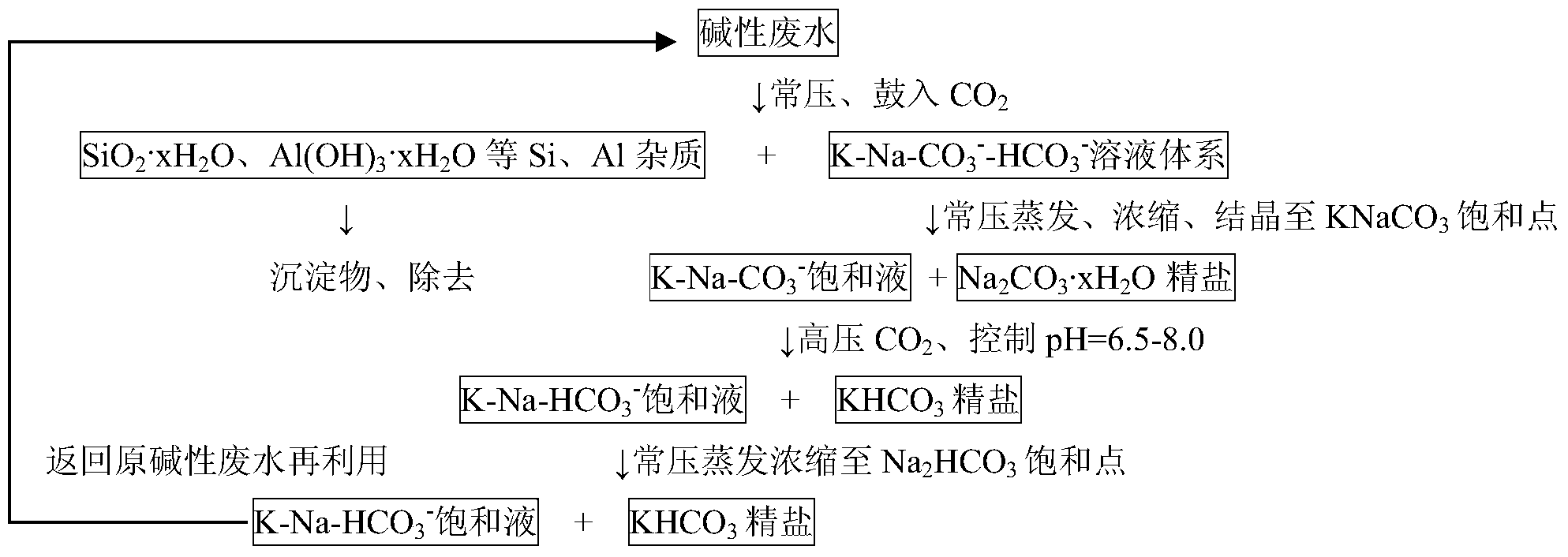
本发明公开了一种从低浓度K+碱液废水体系提取食品级碳酸氢钾的方法,其特征在于:以CO2作为酸化剂,在常压下将含有K+、Na+、SiO32-、AlO2-的碱性废水转化为K-Na-CO3--HCO3-溶液体系,分离、洗涤除去Si、Al杂质;通过常压蒸发浓缩工艺,分离得到Na2CO3;将滤液置于高压釜中,加入高压CO2,控制分离Na2CO3后的滤液pH值、平衡压力及结晶时间,将溶液体系变成K-Na-HCO3-体系,分离、洗涤,获得精制KHCO3,真空干燥后即得食品级KHCO3。本发明方法工艺条件易于操控,实验剂量容易放大,成本低廉;且本发明获得KHCO3产品各项指标达到GB 25589-2010食品级KHCO3各项要求。
摘要附图
权利要求书
1.一种从低浓度K+碱液废水体系提取食品级碳酸氢钾的方法,其特征在于包括如下步 骤:
第1步:取含有K+、Na+、SiO32-和AlO2-的碱液废水,在所述碱液废水中K+浓度为200-400 mg/L、Na+浓度为160-800mg/L、SiO32-浓度为30-50mg/L且AlO2-浓度为15-30mg/L;常压、 搅拌下向所述碱液废水中通入CO2气体,对所述碱液废水进行酸化,至所述碱液废水的pH 值为7.8-8.2时,出现由Si杂质沉淀和Al杂质沉淀构成的白色沉淀,抽滤、洗涤,弃去所述 白色沉淀,获得滤液A;
第2步:采用常压蒸发浓缩工艺,将所述滤液A的密度浓缩至1.28g/cm3,然后降至室 温并在室温下结晶2.0h,出现白色晶体,即为含有结晶水的Na2CO3晶体;分离获得滤液B 和含有结晶水的Na2CO3晶体,对所述含有结晶水的Na2CO3晶体煅烧获得Na2CO3;
第3步:将滤液B置于高压釜中,加入高压CO2,控制滤液B的pH值在6.5-8.0,平衡 压力为0.2-0.5MPa,结晶时间为1.0-3.0h,将滤液B变成K-Na-HCO3-溶液体系,此时,在 所述K-Na-HCO3-溶液中出现晶体沉淀,即KHCO3结晶水合物,分离、洗涤,即获得精制 KHCO3。
第4步:将步骤3中剩余的K-Na-HCO3-溶液进一步在常压下80~100℃蒸发,获得结晶 物,亦为KHCO3结晶水合物;过滤分离、洗涤,获得精制KHCO3和滤液C;
第5步:将第3步和第4步得到的精制KHCO3合并,80℃下真空干燥6h,即获得食品 级KHCO3产物。
第6步:将第4步的滤液C回收并投入下一轮的碱液废水中再利用。
2.根据权利要求1所述的方法,其特征在于:第1步所用碱液废水为电解废液或工业合 成沸石分子筛的废液。
3.根据权利要求1所述的方法,其特征在于:第2步中获得的Na2CO3纯度>99.9%,达 到分析纯要求,可以作为分析纯试剂直接出售或使用。
说明书
一种从低浓度K+碱液废水体系提取食品级碳酸氢钾的方法
技术领域
本发明涉及一种提取食品级碳酸氢钾的工艺,具体涉及由K+碱液废水体系提取食品级碳 酸氢钾的方法。
背景技术
碳酸氢钾是一种重要的化工原料,主要用作生产碳酸钾、醋酸钾、亚砷酸钾等,亦用于 医药、食品、灭火剂等行业。包括碳酸氢钾在内的钾盐(K2CO3、KCl、K2SO4等)是一种战 略物资,在国民经济中的地位至关重要。然而我国可开发水溶性钾盐资源矿床甚少,探明储 量仅占世界的1.06%。目前,我国钾盐的对外依存度高达70%。因此,从碱性工业废水中提 取碳酸氢钾,在一定程度上可以缓解我国钾盐短缺的现状。(1.林耀庭,李为均,从世界钾盐、 钾肥生产和消费情况谈我国对策.中国井矿盐,1994,2,14-18;2.马鸿文,冯武威,苗世顶, 王英滨,田树信,一种新型钾矿资源的物相分析及提取碳酸钾的实验研究.中国科学D辑 2005,35(5),420-427;3.苗世顶,马鸿文,王英滨,白峰,戚洪彬,利用合成沸石母液制取电 子级碳酸钾.矿产综合利用2004,4,3-6;4.苗世顶,王英滨,马鸿文,高钾铝硅酸盐物料中 K2O含量的测定.地球科学2005,30(03),343-346;5.刘香英,王英滨,K+、Na+、CO32-、 HCO3--H2O交互四元体系相平衡研究.铀矿地质2008,24(2),123-127;6.Li,J.;Zeng,Y.;Yu, X.;Peng,Y.,Solubility of the Aqueous Reciprocal Quaternary System Li+,Na+//CO32-,SO42--H2O at 273.15K.J.Chem.Eng.Data 2013,58(2),455-459;7.郑志远,曾英,林晓峰, K2CO3-Na2CO3-H2O三元体系273K相平衡实验研究.盐业与化工2006,36(1),7-9;8.马鸿文, 王英滨,苗世顶,张晓云,戚洪彬,中国专利,中国地质大学(北京),2003.1.17)
发明内容
本发明旨在提供了一种从低浓度K+碱液废水体系提取食品级碳酸氢钾的方法。
本发明解决技术问题,采用如下技术方案:
本发明从低浓度K+碱液废水体系提取食品级碳酸氢钾的方法,其特点在于包括如下步 骤:
第1步:取含有K+、Na+、SiO32-和AlO2-的碱液废水,在所述碱液废水中K+浓度为200-400 mg/L、Na+浓度为160-800mg/L、SiO32-浓度为30-50mg/L且AlO2-浓度为15-30mg/L;常压、 搅拌下向所述碱液废水中通入CO2气体,对所述碱液废水进行酸化,至所述碱液废水的pH 值为7.8-8.2时,出现由Si杂质沉淀和Al杂质沉淀构成的白色沉淀,抽滤、洗涤,弃去所述 白色沉淀,获得滤液A;
第2步:采用常压蒸发浓缩工艺,将所述滤液A的密度浓缩至1.28g/cm3,然后降至室 温并在室温下结晶2.0h,出现白色晶体,即为含有结晶水的Na2CO3晶体;分离获得滤液B 和含有结晶水的Na2CO3晶体,对所述含有结晶水的Na2CO3晶体煅烧获得Na2CO3;
第3步:将滤液B置于高压釜中,加入高压CO2,控制滤液B的pH值在6.5-8.0,平衡 压力为0.2-0.5MPa,结晶时间为1.0-3.0h,将滤液B变成K-Na-HCO3-溶液体系,此时,在 所述K-Na-HCO3-溶液中出现晶体沉淀,即KHCO3结晶水合物,分离、洗涤,即获得精制 KHCO3。
第4步:将步骤3中剩余的K-Na-HCO3-溶液进一步在常压下80~100℃蒸发,获得结晶 物,亦为KHCO3结晶水合物;过滤分离、洗涤,获得精制KHCO3和滤液C;
第5步:将第3步和第4步得到的精制KHCO3合并,80℃下真空干燥6h,即获得食品 级KHCO3产物。
第6步:将第4步的滤液C回收并投入下一轮的碱液废水中再利用。
上述方法的第1步所用碱液废水为电解废液或工业合成沸石分子筛的废液。
上述方法的第2步中获得的Na2CO3纯度>99.9%,达到分析纯要求,可以作为分析纯试 剂直接出售或使用。
所得食品级KHCO3产物按照GB 25589-2010标准进行性能测试。指标包括:总碱量(以 KHCO3计)、水不溶物含量、干燥减量、pH(100g/L溶液)、重金属(以Pb计)/(mg/kg) 以及砷(As)/(mg/kg)。针对工业废水中含有Si、Al等杂质,本申请还给出了样品的Si含 量(以SiO2计)与Al含量(以Al2O3计)。
本发明的有益效果体现在:
本发明所使用是低浓度K+碱液废水,经蒸发、结晶、过滤、洗涤等简单步骤,即可获得 KHCO3精制产物,工艺条件易于操控,实验剂量容易放大,成本低廉;且本发明获得KHCO3产品各项指标达到GB 25589-2010食品级KHCO3各项要求;本发明中物料尽其用,KHCO3的收率达90%以上;此外本发明方法实现了CO2的资源化利用,并容易实现提纯分离液的回 收与循环利用,是一项绿色技术;通过控制pH值、溶液密度及结晶时间,本发明的方法能 够与现有工业蒸发、结晶装置对接。
