据报道,中国印染废水产生量约19.19 亿t,占重点行业排放废水总量的11%,广东省位列第3。印染废水中含有大量的印染助剂、染料和染料的中间产物如多环芳烃(PAHs)等。PAHs具有极强的致畸、致癌及致突变性,对环境造成严重污染的同时危害人类健康。有研究表明,印染废水中PAHs总浓度达(1 349.51±35.77) ng·L−1,其中Phe浓度高达125 ng·L−1,在16种PAHs中含量较高。人体在0.75 mg·L−1的PAHs空气中,经过10~15 min,上呼吸道黏膜及眼睛会受到剧烈刺激。
典型的Fenton体系是基于羟基自由基(·OH)的高级氧化技术。近年来,Fenton与其他方法的联用也广泛应用于降解持久性有机污染物,如高铁酸钾-Fenton法、UV/Fenton法、US/Fenton法等。已有研究表明,US在Fenton体系中能起到传质及搅拌的作用,促进Fe2+和反应中产生的·OH扩散,使其更有效地与污染物接触反应。另外,US空化作用也会产生·OH,使溶液中的·OH增多,而且Fe2+或者反应中产生的Fe3+还能对US空化产生·OH起到催化作用。因此,US/Fenton已被证明具有协同作用。US/Fenton能显著提高印染废水中COD的去除效果,但该体系对有机污染物PAHs的降解动力学及中间产物的形成原因鲜见报道。
基于此,本研究以PAHs中的典型有机物Phe为研究对象,采用了US/Fenton技术对其进行降解研究,主要考察pH、H2O2投量、反应温度、H2O2:Fe2+比例、超声功率等反应因素对US/Fenton技术降解Phe的影响。采用GC/MS分析该技术条件下Phe的中间产物,推出US/Fenton降解Phe的可能途径,为实际印染废水中PAHs的降解提供理论支撑,也为US/Fenton降解印染污泥中的多环芳烃的产物途径提供了参考。
1 材料与方法
1.1 主要试剂和仪器
实验用品:甲醇、丙酮、二氯甲烷和正己烷均为高效液相色谱级。硫酸亚铁和过氧化氢(质量分数30%)均为分析纯试剂(天津大茂化学试剂厂)。Phe标准品(德国DR)。
仪器:气相色谱-质谱联用仪(7890B GC-5977B MS);超声波清洗机KQ-300D(东莞市科桥超声波设备有限公司) ;固相萃取小柱为CNWBOND HC-C18 6 mLSPE小柱;pH 计(pHS-3C);旋转蒸发仪RE-52A(上海亚荣生化仪器厂);氮吹仪N-EVAP(英国Organomation);超纯水设备Milli-Q(法国Milipore);SUPELCO固相萃取装置。
1.2 实验方法
反应在一定温度、避光条件下进行,取适量Phe的标准水溶液(200 ng·mL−1),采用稀硫酸溶液调节pH至适值,将烧杯放入超声池中,加入一定量FeSO4及H2O2溶液,改变超声强度,反应一段时间后,吸取5 mL溶液进行固相萃取。
固相萃取方法:1)先用10 mL二氯甲烷,10 mL甲醇和20 mL超纯水活化小柱;2)缓慢加入待萃取液至活化的SPE柱中,流速约为5 mL·min−1;3)再用10 mL的超纯水淋洗小柱;4)低真空抽干30 min,最后用10 mL体积比为3:7的二氯甲烷:正己烷洗脱;5)收集的洗脱液旋蒸浓缩,并用正己烷置换溶剂,常温下用微弱的氮气浓缩至0.5 mL左右,再用正己烷定容至1 mL。
1.3 分析方法
反应后的水溶液以二氯甲烷为萃取剂连续液-液萃取3次,经过旋转蒸发,氮吹浓缩,用正己烷定容至1 mL,采用气相色谱-质谱仪(GC-MS)对其定性分析。
GC-MS分析条件:进样口温度290 °C,载气为高纯氦气,载气流速为20 mL·min−1,1 μL 无分流进样。GC-MS升温程序:初始温度为80 °C,保留1 min;以3 °C·min−1的速度上升到161 °C;再以5 °C·min−1的速度上升到220 °C;最后以10 °C·min−1的速度上升到310 °C,保留5 min。后运行310 °C,保持5 min。
2 结果与讨论
2.1 US/Fenton降解Phe的影响因素
2.1.1 H2O2对Phe降解效果的影响
超声强度为300 W,pH为3.0,温度为30 °C,H2O2 : Fe2+=10 : 1,考察H2O2投量(10、20、36、50、70 mmol·L−1)对US/Fenton降解Phe的影响,结果如图1所示。Phe降解率和反应速率常数(k)均随着H2O2投量的增大而增加。反应60 min后,当H2O2投量从10 mmol·L−1增加到20 mmol·L−1时,Phe的降解率从46.2%增加到66.1%,k由0.005 min−1增加到0.008 min−1,增加幅度较小;H2O2投量从20 mmol·L−1增加到70 mmol·L−1时,Phe的降解率迅速增加,反应60 min后从66.1%增加到98.3%,k也增加到0.04 min−1。这说明H2O2投量的增大对Phe降解具有明显的促进作用。在苟玺莹等的研究中也发现H2O2投量增大,AAP的去除效果更好。因为H2O2投量的增大,与Fe2+产生的·OH也相应增多,从而促进Phe降解。然而,也有研究表明,过量的H2O2会一定程度地捕获·OH,使Fenton的反应速率常数会降低。在图1(b)中,当36 mmol·L−1升高至50 mmol·L−1时,降解效果不明显,k值相似,可能原因是H2O2浓度过量时发生分解。而当H2O2升至70 mmol·L−1时,在反应初期,H2O2与Fe2+迅速反应,产生·OH与Phe反应,但与此同时,还产生了氢氧化铁沉淀,而反应溶液里的Phe有可能黏附在氢氧化铁颗粒上而得到去除,而本实验只测了水溶液中的Phe,所以Phe的降解率会大幅度上升。芬顿反应时间为60 min时,添加量为36、50和70 mmol·L−1时的降解率增幅不大,均在95%左右,为了节约试剂用量,最后选用H2O2添加量为36 mmol·L−1来进行后面的研究。
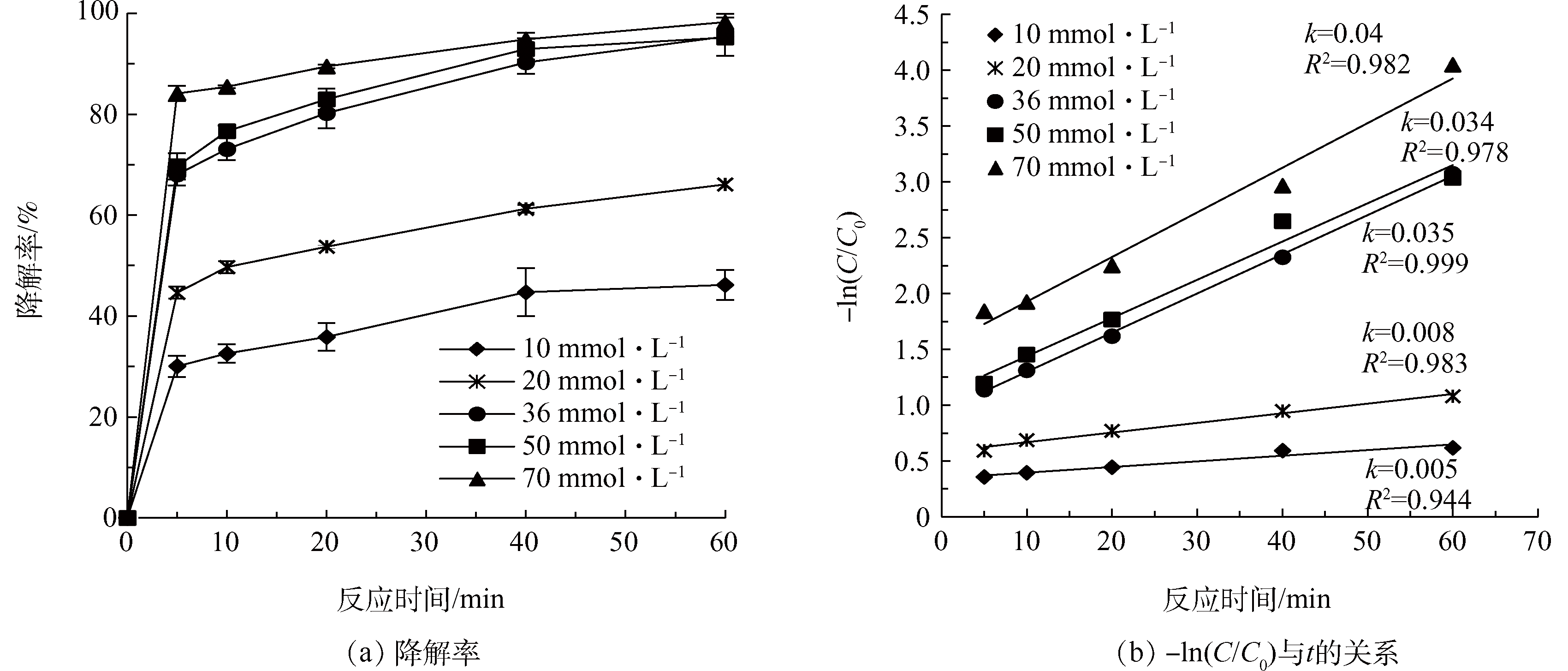
图1 不同H2O2投量对Phe降解效果的影响
2.1.2 温度对Phe降解效果的影响
在超声强度为300 W,H2O2投量为36 mmol·L−1,H2O2:Fe2+=10:1,pH为3.0,考察温度(20、30、40、60 °C)对US/Fenton降解Phe的影响,结果如图2(a)所示。Phe的降解率随温度升高而增大。反应60 min后,Phe的降解率从78%增加到99.6%,k从0.015 min−1增加到0.180 min−1。说明温度的升高对Phe的降解有促进作用。欧晓霞等研究也发现,在温度低于70 °C时,随着温度的升高,提高了酸性品红的降解率。BENDOUZ等也发现,当温度升高时,Fenton氧化降解PAHs也随之增大,与本研究的结果一致。分析原因,在US/Fenton体系中,温度升高,H2O2的活性也随之增大,同时传质速率也增大,从而导致Phe与·OH的反应速率得以提高。
活化能的大小反映了反应速率随着温度的变化程度。表观活化能可通过Arrhenius方程中各温度下的lnk-(1/T)关系图(图2(c))得到。
依据图2(c)中的数据,lnk对1/T线性拟合后,得到直线方程y=-6 130x+16.79,R2=0.983,计算的Ea=50.96 kJ·mol−1。有资料表明:Ea<40 kJ·mol−1时,反应可在室内温度下瞬时完成;Ea>100 kJ·mol−1时,则要适当地进行加热反应才能进行。US/Fenton降解Phe的Ea<100 kJ·mol−1,活化能较小,因此温度对该反应速率的影响不大。可以认为该反应能够在室温下迅速反应,符合实际废水的处理要求。所以,在接下来的研究中选择室温进行。
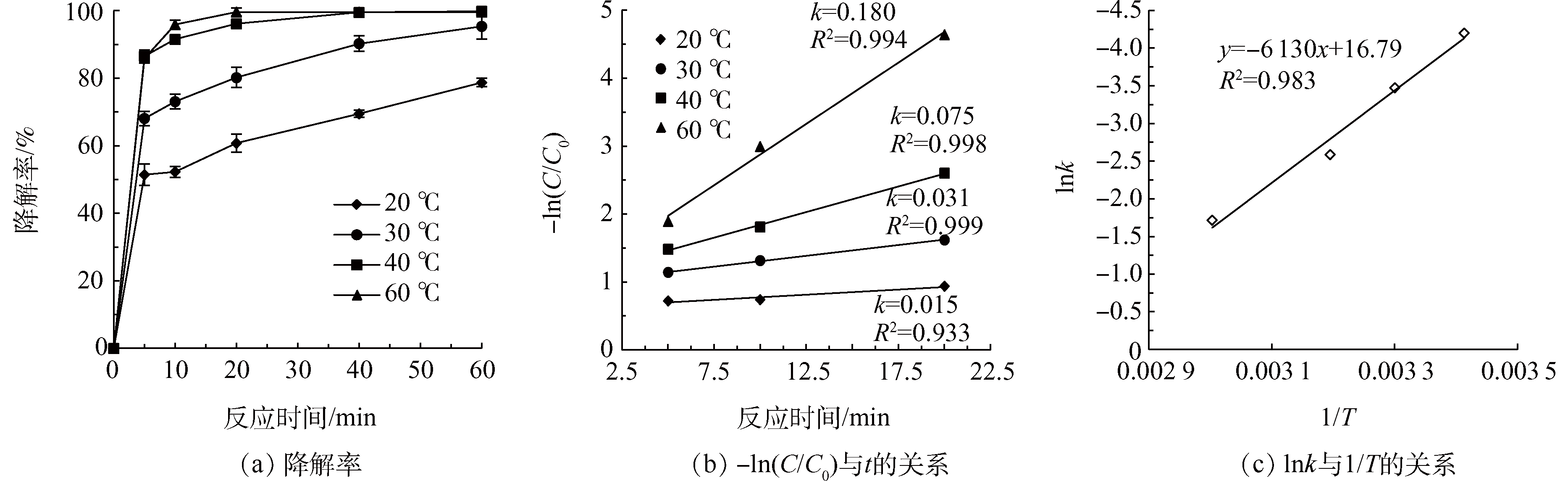
图2 不同温度对Phe降解效果的影响
2.1.3 H2O2:Fe2+比值对Phe降解效果的影响
在超声强度为300 W,H2O2投量为36 mmol·L−1, pH为3.0,温度为30 °C,考察H2O2:Fe2+摩尔比(2:1、5:1、10:1、20:1)对US/Fenton降解Phe的影响,结果如图3所示。反应60 min后,H2O2:Fe2+从20:1减少到2:1时,Phe的降解率从80.3%增加到99%,k由0.019 min−1增加到0.052 min−1。这说明,在H2O2浓度不变的前提下,Phe的降解率和反应速率常数随Fe2+浓度的增大而增大。分析其原因,在Fenton体系中,H2O2通过Fe2+催化产生·OH。若Fe2+不足,难以使H2O2分解产生足量的·OH,使有机物降解。在本实验中,H2O2:Fe2+为10:1时,最终的降解率也能达到95%,因此,为了减少Fe2+的量,接下来的实验选择H2O2:Fe2+=10:1进行研究。具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
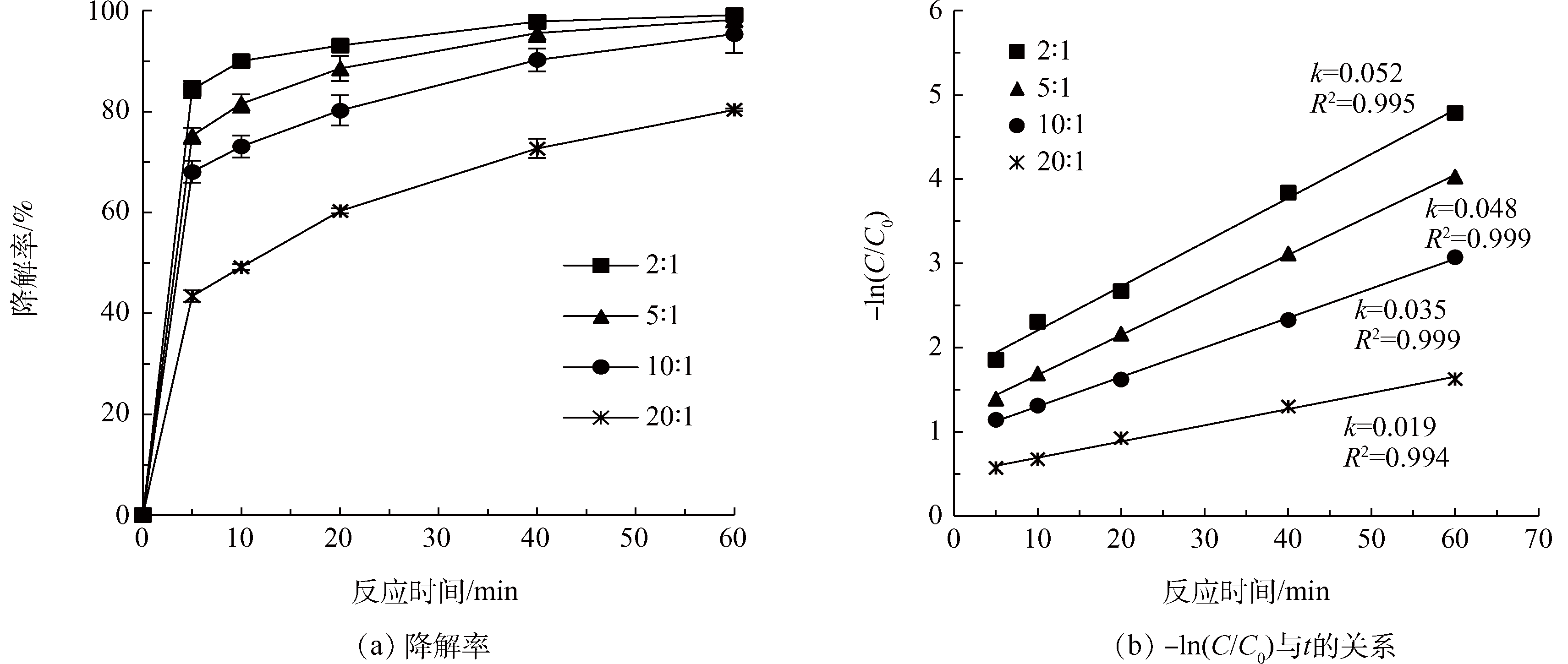
图3 不同H2O2 : Fe2+摩尔比对Phe降解效果的影响
2.1.4 超声功率对Phe降解效果的影响
H2O2投加量为36 mmol·L−1,H2O2:Fe2+=10:1,pH为3.0,温度为30 °C,考察不同超声强度(200、250、300、400、500 W)对US/Fenton降解Phe的影响,结果如图4所示。反应60 min后,当超声功率从200 W增加到300 W时,Phe的降解率从86%增加到95%,而k从0.019 min−1增加到0.35 min−1;当超声功率大于300 W之后,Phe的降解率从95%降低到68.4%,而k也从0.035 min−1减少到0.012 min−1。随着超声的变化,降解率有所变化,说明了超声对Fenton有一定的促进作用。分析其原因,由于超声波产生空化效应,随着声能密度增加,空化效应也越剧烈,进而溶液中产生更多空气气泡和·OH,促进Phe的降解;当超声功率增加到一定程度后,声能密度不断加大,致使空化泡没有足够时间破裂,进而空气泡在声波的负压相里不断增大,从而形成超声屏障,抑制Phe的降解。戴丽雅等的研究也表明,超声功率为250 W时,超声芬顿对COD的降解最佳。陈颖等[12]的研究也发现,超声功率为120 W时,超声/芬顿法对准好氧矿化垃圾反应床出水COD去除率最高。因此,最佳超声功率为300 W。
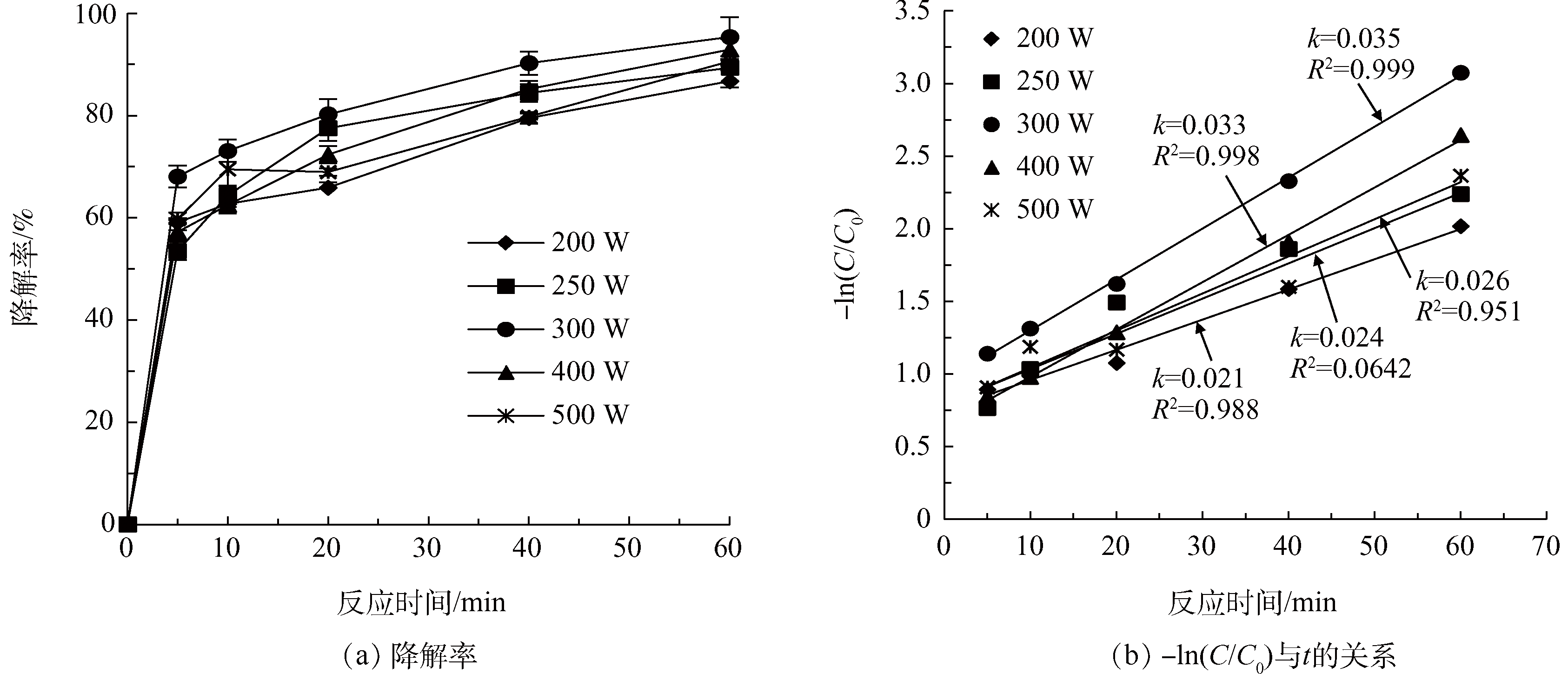
图4 不同超声功率对Phe降解效果的影响
2.1.5 pH对Phe降解效果的影响
在超声强度为300 W,H2O2投量为36 mmol·L−1,H2O2:Fe2+=10:1,温度为30 °C,考察pH(2.0、3.0、4.0、6.0、10.0)对US/Fenton降解Phe的影响,结果如图5所示。Phe的降解率随pH升高而减少。pH由2.0增加到3.0时,降解率从85.4%增加到95%,降解率达到最大值。而pH>3.0时,随着pH的增大,降解率逐渐减小,最小为54.1%。从图5(b)可知, k也呈现相似的规律:pH为3.0时,k最大,为0.035 min−1;在pH由2.0升至3.0时,k由0.019 min−1增加到0.035 min−1;而弱酸至碱性条件下,pH继续升高,pH=10.0时,k降低至0.005 min−1。说明在酸性条件下,Phe降解效果最佳,碱性条件不利于Phe的降解。在李婷等[5]的研究中,发现在酸性条件(pH=3)下,PAHs的降解率最高。因为pH过低,会抑制Fe2+的再生,从而影响了·OH的生成;在中性或者碱性条件下,Fenton体系中的Fe3+会生成Fe(OH)3沉淀,消耗了Fe3+,Fe2+的再生受影响,从而抑制Phe的降解。所以,pH=3.0为US/Fenton降解水中Phe的最佳pH条件。
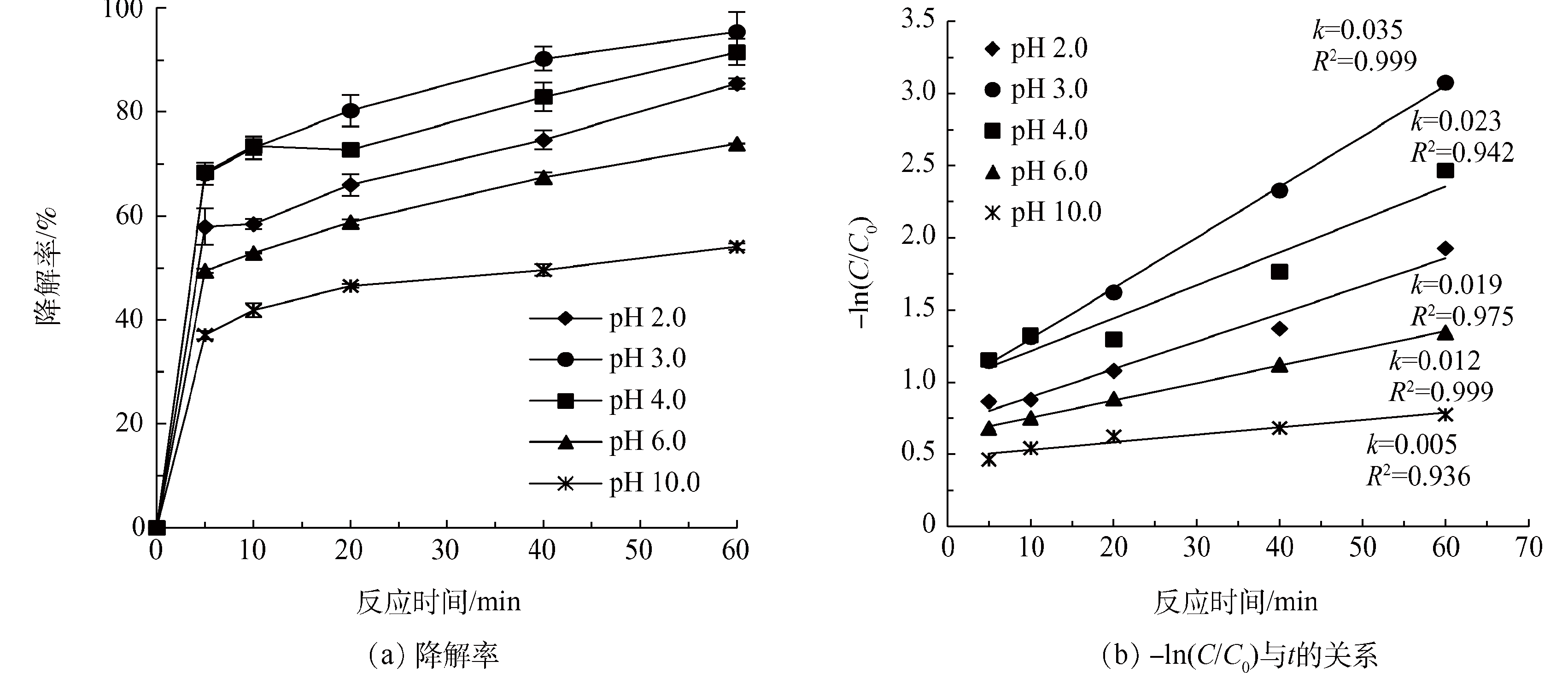
图5 不同pH对Phe降解效果的影响
2.2 Phe的降解产物及途径分析
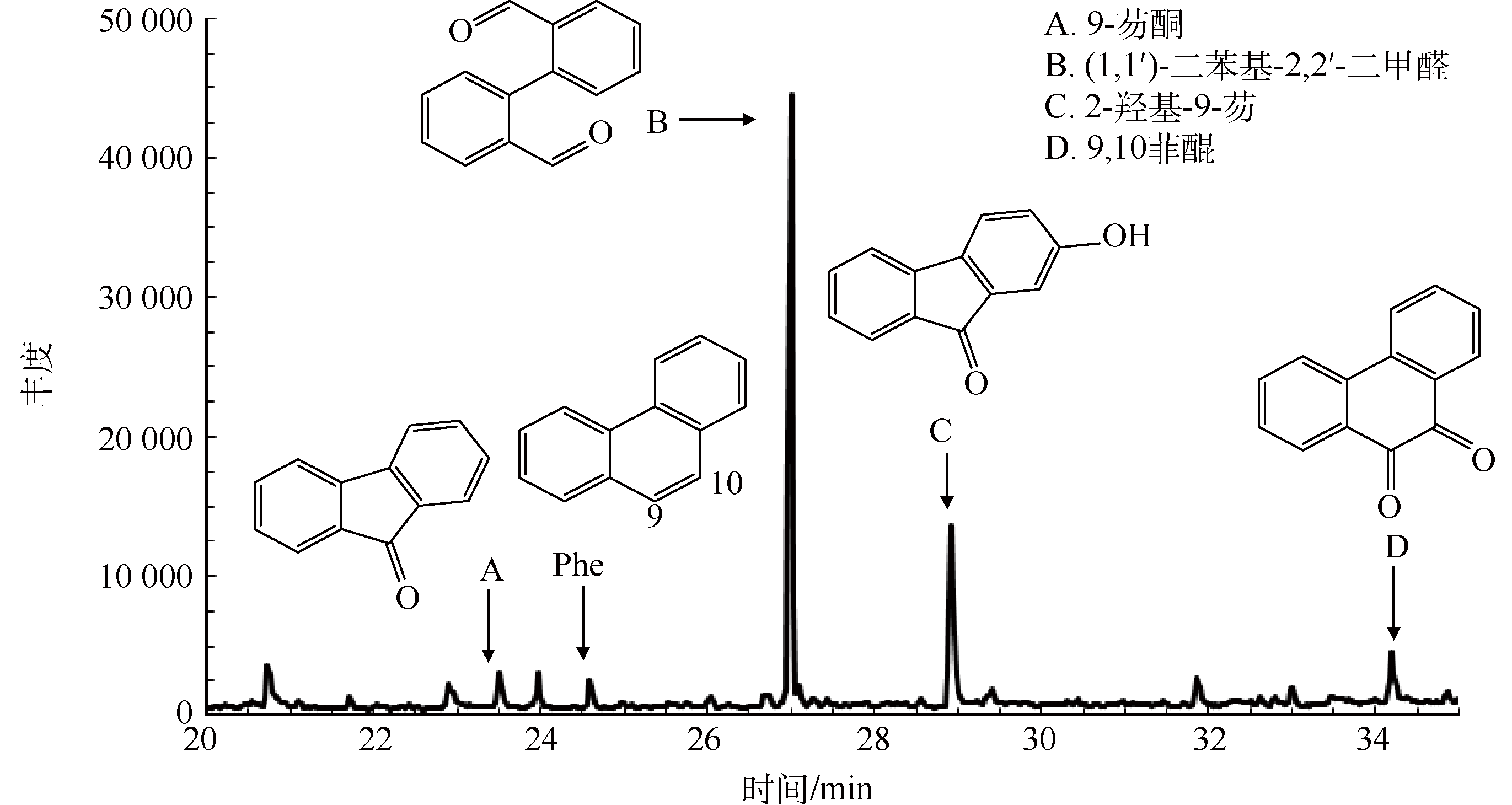
图6 US/Fenton降解Phe的GC/MS色谱图及中间产物
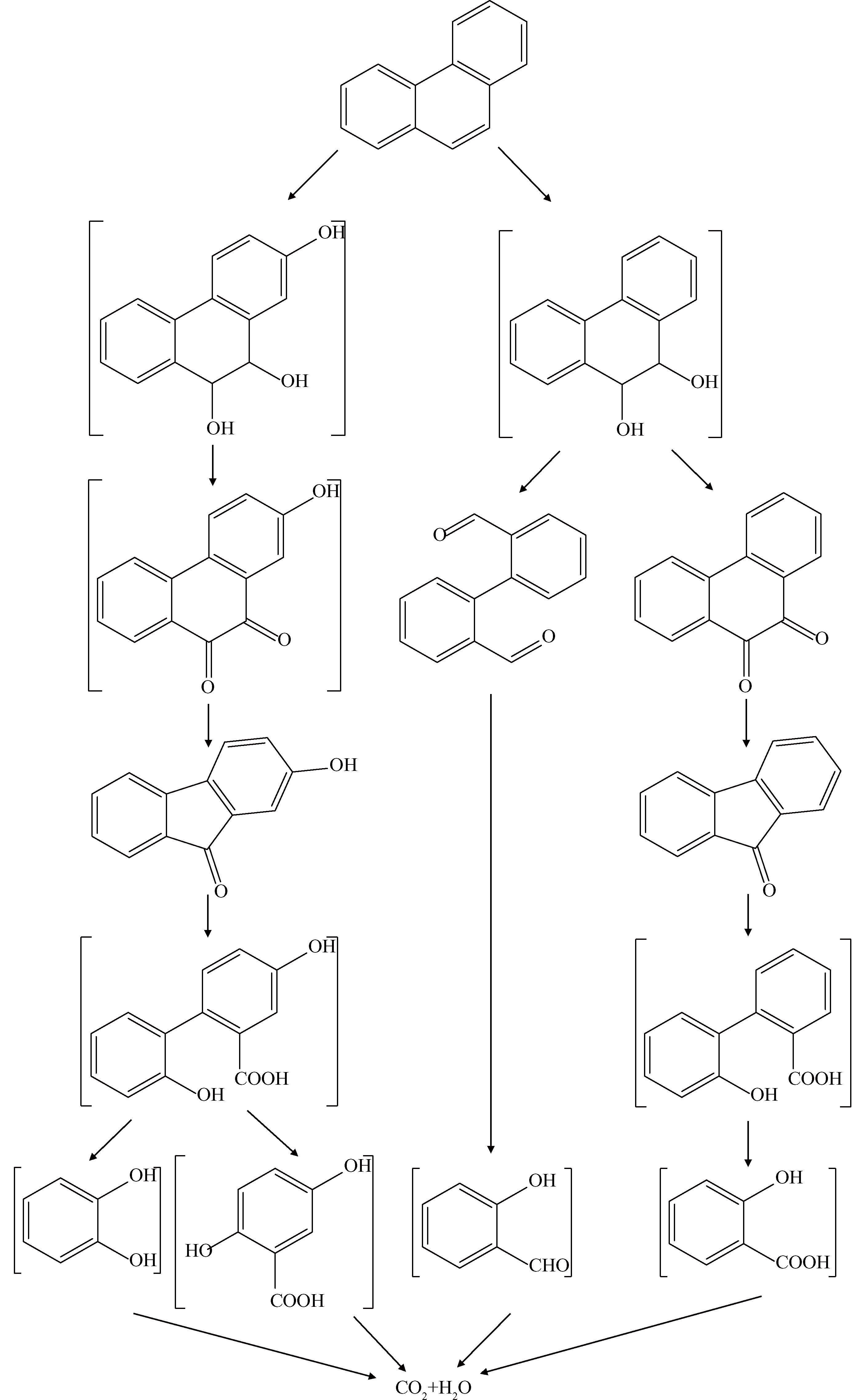
如图6所示,在室温,pH=3.0,US=300 W,H2O2=36 mmol·L−1,H2O2 : Fe2+=10 : 1的条件下降解Phe所得的中间产物A~D。Phe的主要降解产物有9-芴酮(A)、(1,1′)-二苯基-2,2′-二甲醛(B)、2-羟基-9-芴(C)、9,10菲醌(D)。Phe的降解途径的推测如图7所示。根据Clar’s芳香π键理论,Phe只存在2个稳定的苯环,另外还有1个C=C双键(9,10位点),所以遇到·OH的时候,苯环上9,10位点首先被攻击,生成9,10-二氢菲-2,9,10-三甲醇。菲结构的9,10位点进一步与体系中的铁离子(Fe3+)进行醌基化反应,形成2-氢菲-9,10醌。再进一步氧化成C,由于苯环是个大π键结构,断链所需的能量比一般的C—C单键要高很多,所以·OH再进一步攻击C—C单键,使其断键,生成邻苯二酚和2,5-二羟基苯甲酸,最后被完全矿化。Phe同时进行的降解过程还有9,10-二氢菲-9,10-二甲醇,进一步醌基化生成B和D。B进一步氧化,生成邻羟基苯甲醛,同样被最终矿化。同时D氧化成A,再进一步氧化生成水杨酸,最终矿化成CO2和H2O。
图7 US/Fenton降解Phe途径的推测
3 结论
1)US/Fenton降解Phe的反应符合伪一级动力学模型。影响US/Fenton降解Phe的主要因素有pH、H2O2投量、反应温度、H2O2:Fe2+比值、超声功率,其中pH对该体系的影响最大。
2)US/Fenton降解Phe的主要产物有9,10菲醌、(1,1′)-二苯基-2,2′-二甲醛、9-芴酮、2-羟基-9-芴,反应体系中·OH首先对菲上的9,10位点进行攻击,生成醇类有机物,然后会进一步被氧化成醌类有机物,最终矿化成CO2和H2O。
3)US/Fenton体系的最佳反应条件为:pH=3.0,US=300 W,H2O2投量为36 mmol·L−1,H2O2:Fe2+=10:1,T=313 K,降解率达到95%。(来源:环境工程学报 作者:孔敏仪)
